Les scientifiques ont travaillé à partir d’un modèle mathématique et de données publiques disponibles en France par département. © Adobe Stock
Des chercheurs de l’université et du CHU de Bordeaux, de l’Inserm et d’Inria publient des estimations sur l’efficacité des mesures restrictives (confinement, couvre-feu…) et de la politique vaccinale à partir d’une modélisation mathématique des données françaises. Ces résultats sont publiés dans la revue Epidemics.
La crise sanitaire de Covid-19 a provoqué une situation inédite, du fait du nombre considérable de décès et d’hospitalisations mais aussi en termes de mesures instaurées pour lutter contre la propagation du virus : confinement, couvre-feu, fermeture des écoles et des frontières… Peu de données étaient disponibles à ce moment-là pour mesurer leur efficacité. Près de 3 ans après le début de la pandémie, il est primordial d’estimer l’impact de ces mesures ainsi que l’efficacité du vaccin afin de se préparer à d’éventuelles nouvelles épidémies. Il faut aussi tenir compte des coûts économiques, psychologiques et sociétaux de ces mesures.
Des chercheurs de l’université et du CHU de Bordeaux, de l’Inserm et du Centre Inria de l’université de Bordeaux, associés à des chercheurs canadiens de l’université de McGill, ont travaillé à partir d’un modèle mathématique et de données publiques disponibles en France par département, entre mars 2020 et octobre 2021. Ils publient, dans la revue Epidemics, des estimations précises de l’effet des mesures de confinement, couvre-feu et vaccination.
Impact majeur des confinements et couvre-feux
Leurs résultats montrent que les mesures les plus restrictives telles que le confinement et le couvre-feu ont eu un effet important sur la réduction de transmission du virus. Le premier confinement a été le plus efficace avec une réduction de la transmission de 84 %. Un couvre-feu à 18h était plus efficace qu’à 20h (réduction de 68% contre 48%). Bien que les fermetures d’écoles aient eu un
effet plus limité, elles ont tout de même réduit la transmission de 15%.
Rodolphe Thiébaut, professeur en Santé Publique au centre de recherche Bordeaux Population Health1 et responsable de cette étude, explique que ces données sont cohérentes avec d’autres études déjà publiées, notamment par l’OMS. « Bien que l’exercice soit complexe d’estimer un nombre de personnes sauvées par une intervention spécifique, toutes les études retrouvent un impact majeur du confinement et de la vaccination. »
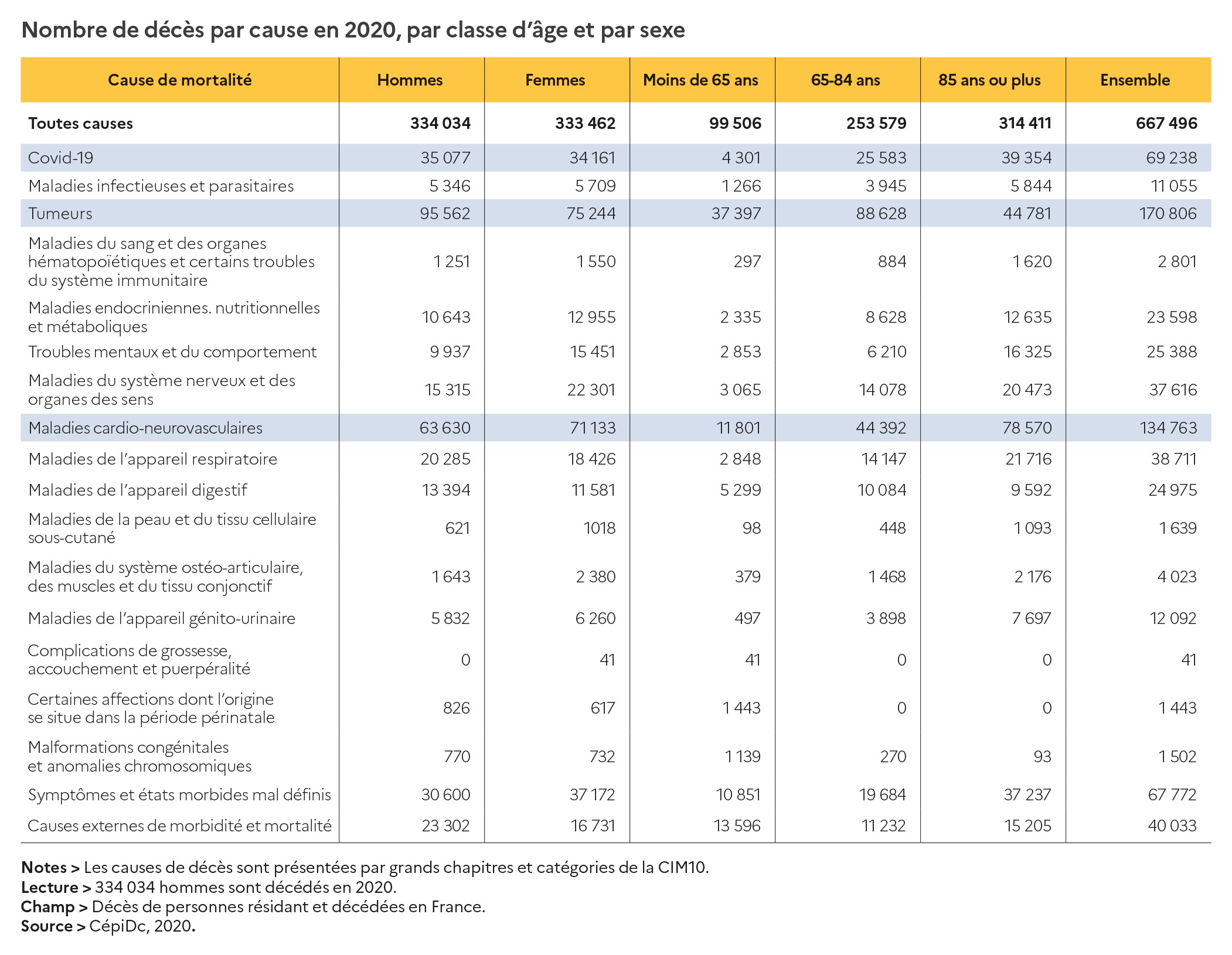
Dans le cadre de cette étude, les chercheurs ont aussi simulé différents scénarios, comme prédire une situation sans vaccin, jusqu’à la fin de la période d’analyse (octobre 2021). Leurs données prédisent 159 000 décès supplémentaires et 1,48 millions en plus de cas d’hospitalisation en France en l’absence de vaccination. Soit le double de décès car l’épidémie a causé 116 000 décès dans notre pays et entraîné 460 000 hospitalisations (selon l’INSEE).
Dans un scénario inverse, c’est-à-dire avec un vaccin au bout de 100 jours – ce qui était au départ l’objectif de la Coalition internationale pour les innovations en matière de préparation aux épidémies (CEPI)2 – 71 000 décès et 384 000 hospitalisations auraient pu être évités soit près de 80 % des décès et ¾ des hospitalisations. « Ce résultat met l’accent sur l’importance d’un déploiement rapide et précoce des vaccins », déclare le professeur Rodolphe Thiébaut.
Il souligne la nécessité de prendre d’ores et déjà en compte cette question dans le cadre hypothétique d’une nouvelle pandémie, et donc de mettre en place une stratégie de recherche et développement vaccinal optimale.
Enfin, une simulation a montré qu’un confinement en France une semaine plus tôt aurait permis d’éviter 20 000 décès. Le chercheur en santé publique commente ces chiffres : « Le début d’une épidémie est exponentiel. C’est évidemment une décision lourde de confiner tout un pays mais ces résultats peuvent contribuer à la prise rapide de décisions dans le cadre de résurgences épidémiques. »
Il faut rappeler qu’il s’agit d’un travail méthodologique avec certaines limites qui doivent être prises en compte dans l’interprétation des résultats : la structure d’âge n’a pas pu être prise en compte (ce qui peut conduire à une sous-estimation de l’efficacité du vaccin)3, tout comme la fermeture des commerces non-essentiels ou encore l’effet propre des gestes barrières. Par ailleurs, les données ne peuvent pas d’emblée être généralisées à d’autres pays.
1 Rodolphe Thiébaut est professeur de santé publique (biostatistique et informatique médicale) à l’université de Bordeaux et chef du service d’information médicale du CHU de Bordeaux. Il dirige le groupe de recherche Statistiques pour la médecine translationnelle (SISTM de l’Inserm et du centre Inria de l’université de Bordeaux), consacré à la modélisation et à l’étude statistique de données de grande dimension et est rattaché au Centre de recherche Bordeaux Population Health (BPH – unité Inserm et université de Bordeaux).
2 La Coalition pour les innovations en matière de préparation aux épidémies (CEPI, Coalition for Epidemic Preparedness Innovations) a été créée à l’occasion du forum mondial de Davos, afin de financer le développement de vaccins contre les maladies infectieuses émergentes et à en garantir un accès équitable à l’ensemble des populations affectées.
3 les personnes plus âgées, qui sont plus exposées aux maladies graves, à l’hospitalisation et au décès, ont été vaccinées en premier et ont une couverture vaccinale plus élevée que les groupes d’âge plus jeunes.