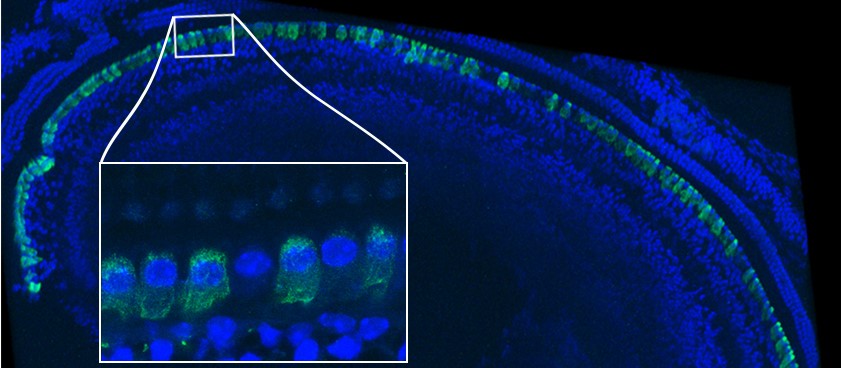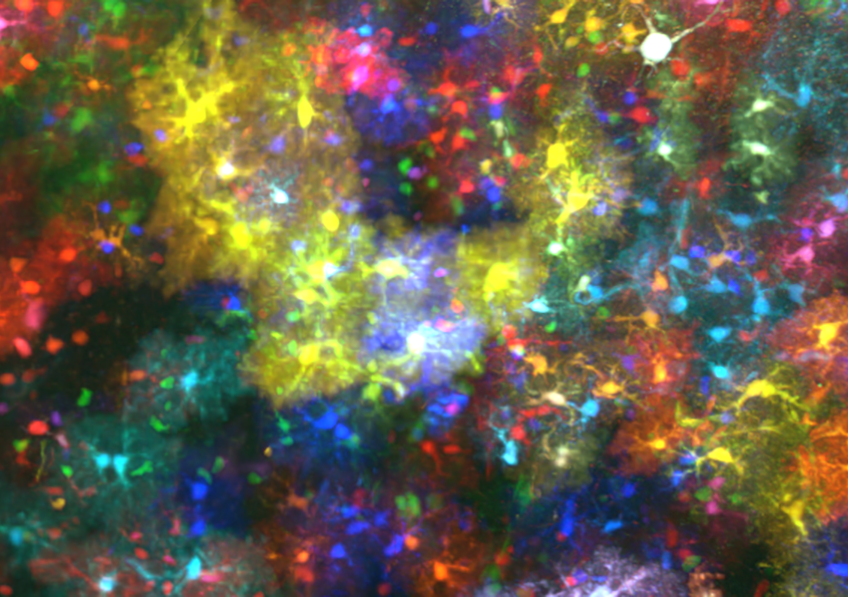
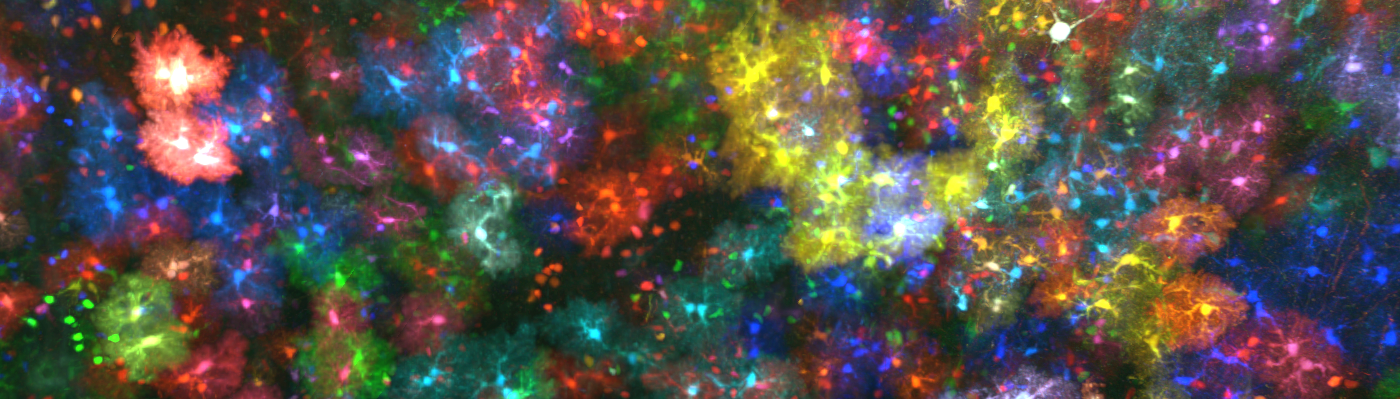
Vue d’un détail d’un volume de 4.8 mm3 de cortex de souris dans lequel les astrocytes sont marqués avec des protéines fluorescentes de couleurs différentes. © Image : Lamiae Abdeladim, LOB, Ecole Polytechnique / CNRS / Inserm ; marquage transgénique : Solène Clavreul, Institut de la Vision, Sorbonne Université / Inserm / CNRS
Mise au point par des chercheurs de l’École polytechnique, de Sorbonne Université, de l’Inserm et du CNRS regroupés au sein du Laboratoire d’optique et biosciences1 et de l’Institut de la Vision2, ChroMS est une nouvelle technique de microscopie associant couleur, 3D et haute résolution, introduisant une véritable révolution dans l’imagerie du cerveau des vertébrés. L’approche ChroMS est décrite en détail dans un article qui vient de paraitre dans Nature Communications.
En matière d’imagerie du cerveau des vertébrés, l’écueil que rencontraient jusqu’à présent les chercheurs était de devoir choisir entre résolution et volume. Soit on obtenait de la très haute résolution avec la microscopie électronique tridimensionnelle, mais sur un volume beaucoup trop faible pour retracer un circuit neuronal complet, soit on obtenait une image entière du cerveau, mais cette fois à une résolution bien trop large pour saisir les détails.
Le principal bénéfice de l’approche d’imagerie ChroMS (pour Chromatic Multiphoton Serial imaging), c’est d’offrir une véritable visite virtuelle à haute résolution (à l’échelle de la cellule) de certaines parties du cerveau essentielles pour comprendre le développement des circuits neuronaux. Si la visite est virtuelle, les données sont bien réelles, issues de cerveaux de souris transgéniques dans les neurones desquelles ont été introduits des marqueurs fluorescents issus de méduses ou de coraux, qui, une fois stimulés par un laser infrarouge, permettent d’obtenir la couleur.
« L’instrument est idéal pour reconstruire en 3D avec une très grande précision des régions du cerveau, de quelques millimètres-cubes de volume, ce qui est une première avec cette qualité d’images, et qui constitue l’échelle pertinente par rapport à ce que nous voulons observer » explique Emmanuel Beaurepaire, du Laboratoire d’optique et biosciences (LOB – École polytechnique, CNRS, Inserm). « Nous pouvons aussi reconstituer un cerveau entier de souris, avec une moindre précision dans la version actuelle de notre instrument ».
« Nous nous intéressons plus particulièrement au lignage cellulaire » précise Jean Livet, de l’Institut de la vision (Sorbonne Université, Inserm, CNRS), « c’est-à-dire la façon dont se développe le cerveau à partir de cellules souches neurales : quelles sont les cellules filles issues d’une cellule souche donnée, comment une mutation de la cellule souche a pu influer sur leur développement, comment les groupes de cellules générées par différentes cellules souches s’agencent les uns par rapport aux autres, c’est toute cette histoire d’une région du cerveau, codée dans la couleur, que nous révèlent les images grand volume de ChroMS ».
En ligne de mire, la capacité de répondre à des questions qui se posent depuis longtemps en neurosciences, comme celle de savoir si les neurones issus d’une même cellule souche se connectent de façon préférentielle entre eux pour remplir une fonctionnalité donnée, ou si des pathologies comme l’épilepsie peuvent être reliées à des problèmes localisés affectant certaines cellules souches neurales.
Si la technique ChroMS est particulièrement adaptée à l’étude d’un organe aussi complexe que le cerveau, elle peut être mise à profit sur tous les organes et devrait s’avérer être un outil très efficace pour les études portant sur l’embryogénèse.
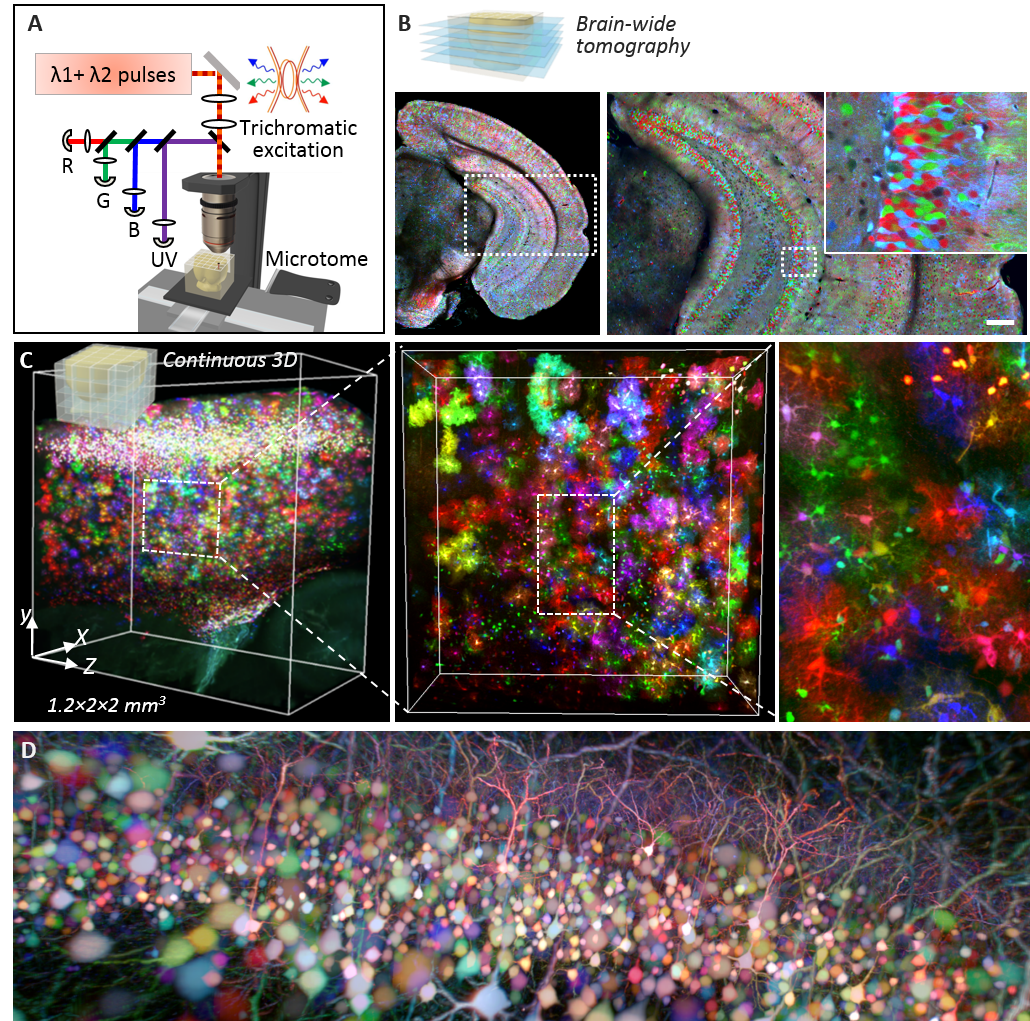
(A) Principe de la microscopie ChroMS, associant excitation biphotonique couleur par mélange de fréquences et découpe sériée automatisée du tissu cérébral. (B) Image acquise avec le mode « tomographie sur cerveau entier » montrant le cortex et l’hippocampe d’une souris Brainbow. (C) Reconstruction 3D et vue à différentes échelles d’un volume de 4.8 mm3 de cortex de souris dans lequel les astrocytes sont marqués avec des protéines fluorescentes de couleurs différentes. (D) Vue 3D de neurones marqués en couleur dans le cortex de souris. Adapté de : Abdeladim et al, Nat Commun 2019.




 © AdobeStock
© AdobeStock