Une collaboration entre une équipe de chercheurs français de l’Unité Inserm 862 « Neurocentre Magendie, Bordeaux » dirigée par Cyril Herry et une équipe de chercheur suisses du Friedrich Miescher Institute of Biomedical Research dirigée par Andreas Lüthi à l’Institut de recherche biomédicale Friedrich Miescher a montré, pour la première fois, que le cortex, la plus importante zone du cerveau qui est généralement associée à de hautes fonctions cognitives, est également une zone clé pour les apprentissages émotionnels. Cette étude initiée par les chercheurs suisses et publiée dans la revue Nature constitue un travail d’avant-garde en matière d’exploration des émotions dans le cerveau.
Les troubles anxieux constituent une famille de pathologies complexes touchant environ 10 % des adultes. Les patients atteints de ces troubles craignent certaines situations ou objets de manière exagérée sans proportion aucune avec le danger qu’ils présentent en réalité. L’amygdale, structure cérébrale profonde, joue un rôle clé dans le traitement de la peur et de l’anxiété. Son fonctionnement peut être perturbé en cas de troubles anxieux.
Bien que les chercheurs connaissent les neurones de l’amygdale et leur rôle dans l’expression de la peur, leur connaissance de l’implication d’autres régions du cerveau reste limitée. Or, il ne peut y avoir de peur sans stimulation sensorielle : avant d’avoir peur, nous entendons, nous voyons, nous sentons, nous goûtons ou nous ressentons quelque chose qui la déclenche. Ce signal sensoriel est notamment traité dans le cortex, région la plus vaste du cerveau.
Pour la première fois, des scientifiques français et suisses ont réussi à visualiser le trajet d’un stimulus sensoriel dans le cerveau lors de l’apprentissage de la peur et à identifier les circuits neuronaux sous-jacents.
Que se passe-t-il dans le cerveau ?
Au cours des expériences réalisées par les chercheurs, des souris ont appris à associer un son à un stimulus désagréable de sorte que le son lui-même devienne désagréable pour l’animal.
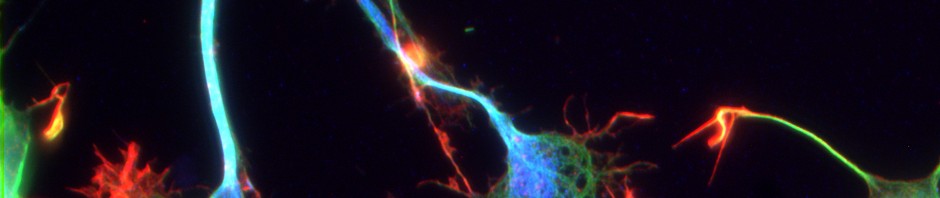
Les chercheurs ont utilisé l’imagerie calcique biphotonique afin de visualiser l’activité des neurones dans le cerveau au cours de ce processus d’apprentissage. Cette technique d’imagerie implique l’injection d’un indicateur chimique qui est ensuite absorbé par les neurones. Lorsque les neurones sont stimulés, les ions calcium pénètrent dans les cellules, où ils accroissent la brillance de l’indicateur, qui peut alors être détecté au microscope à balayage.
Dans des conditions normales les neurones du cortex auditif sont fortement inhibés. Au cours de l’apprentissage de peur, un microcircuit « dés-inhibiteur » au niveau du cortex s’active : Ainsi, pendant une courte fenêtre temporelle au cours de l’apprentissage, la libération d’acétylcholine dans le cortex permet l’activation de ce microcircuit et la désinhibition des cellules de projection excitatrices du cortex. Ainsi, lorsque l’animal perçoit un son pendant l’apprentissage de la peur, il sera traité de façon bien plus intense que dans des conditions normales ce qui favorise la formation de la mémoire. Toutes ces étapes ont été visualisées grâce aux techniques développées par les chercheurs.
Pour confirmer leurs découvertes, les chercheurs ont eu recours à une autre technique récente très innovante (l’optogénétique) pour perturber la dés-inhibition de façon sélective au cours de l’apprentissage. Lorsqu’ils ont testé la mémoire de leurs souris (c’est-à-dire l’association entre le son et le stimulus désagréable) le lendemain, ils ont observé une altération sévère de la mémoire démontrant directement que le phénomène de dés-inhibition corticale est indispensable à l’apprentissage de la peur.
La découverte de ce microcircuit désinhibiteur cortical, ouvre des perspectives cliniques intéressantes et les chercheurs peuvent désormais imaginer, dans des situations bien précises, comment empêcher qu’un traumatisme se mette en place et ne devienne pathologique.