Une équipe de l’Institut Curie et de l’Inserm dirigée par le Dr Olivier Delattre vient de découvrir une nouvelle cible thérapeutique pour les tumeurs d’Ewing, un cancer qui touche près de 100 enfants et adolescents en France chaque année. En effet dans Cancer Research du 29 août 2012, les chercheurs montrent qu’en inactivant la protéine PRKCB, ils empêchent la progression tumorale. Or des inhibiteurs de la PRKCB sont actuellement en cours de développement ; ils pourraient, à terme, faire partie de l’arsenal thérapeutique contre la tumeur d’Ewing.
Chaque année, en France près de 100 nouveaux cas de tumeur d’Ewing sont diagnostiqués chez l’enfant, l’adolescent et le jeune adulte. Aujourd’hui, les formes localisées sont traitées, dans la majorité des cas, par une combinaison initiale de chimiothérapie et de chirurgie. Toutefois, au moment du diagnostic, un quart des jeunes patients sont déjà porteurs de métastases. Malgré les progrès déjà réalisés, la recherche de nouvelles thérapies pour les formes avancées est primordiale pour améliorer encore leur pronostic.
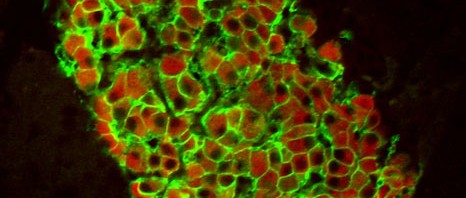
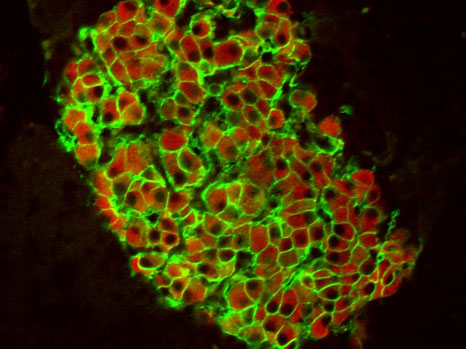
C’est l’une des préoccupations majeures de Franck Tirode, chargé de recherche Inserm à l’Institut Curie dans l’équipe du Dr Olivier Delattre (Unité génétique et biologie des cancers Inserm 830/Institut Curie). Partant de la découverte de l’anomalie chromosomique responsable de la tumeur, il a cherché à identifier les cibles en aval de cette altération. « C’est ainsi que nous avons découvert le rôle majeur de la protéine kinase PRKCB dans le développement de la tumeur d’Ewing. Cette dernière est cruciale pour la survie cellulaire in vitro et le développement tumoral in vivo. » explique Franck Tirode. D’ailleurs, la surexpression de PRKCB est présente dans toutes les tumeurs d’Ewing. C’est une véritable signature de ce cancer pédiatrique qui pourrait à terme devenir un marqueur diagnostique complémentaire de cette tumeur.
A l’instar de l’identification par cette même équipe de la protéine IGFBP3[1] qui a conduit à des essais cliniques ciblant la voie IGF1, l’identification de la PRKCB – surexprimée dans les tumeurs d’Ewing à un taux beaucoup plus élevé que dans d’autres tumeurs – laisse présager des possibilités thérapeutiques prometteuses. « En effet, la nature même de cette protéine en fait une cible idéale pour de nouvelles thérapies » ajoute le chercheur. Pour preuve, il existe déjà des inhibiteurs de la protéine PRKCB en cours d’essai clinique pour d’autres localisations tumorales chez l’adulte.
Toutefois, comme le conclut Franck Tirode, « le plus grand bénéfice en termes thérapeutiques viendra très certainement de l’association d’un inhibiteur de la PRKCB avec d’autres molécules dirigées contre des cibles spécifiquement activées dans les tumeurs d’Ewing, telle que la voie IGF1. »
Avec près de 100 nouveaux cas par an en France, la tumeur d’Ewing est la deuxième tumeur maligne primitive de l’os, en termes de fréquence. Elle survient chez l’enfant, l’adolescent et le jeune adulte (jusqu’à 30 ans), avec un pic de fréquence à la puberté entre 10 et 20 ans. Appelée aussi sarcome d’Ewing, cette tumeur se développe essentiellement dans les os du bassin, les côtes, les fémurs, les péronés et les tibias. C’est à l’Institut Curie qu’a été découverte en 1984, et caractérisée, en 1992, dans l’unité d’Olivier Delattre, l’anomalie chromosomique responsable de cette tumeur. Il s’agit d’une translocation qui se produit, dans 85 % des cas, entre les chromosomes 11 et 22 et aboutit à la synthèse d’une protéine anormale EWS-FLI1, et dans 10 % des cas, entre les chromosomes 22 et 21 et donne lieu à la synthèse d’une protéine anormale EWS-ERG. Il existe d’autres altérations, mais elles sont rares. La découverte de ces altérations génétiques a permis la mise au point, à l’Institut Curie en 1994, d’un test moléculaire diagnostic de la tumeur d’Ewing.
Aujourd’hui, les formes localisées sont traitées majoritairement par une combinaison initiale de chimiothérapie et de chirurgie. Une chimiothérapie postopératoire, et parfois une radiothérapie, complètent le traitement. Le pronostic de la tumeur d’Ewing a bénéficié de l’apport de nouvelles chimiothérapies.
L’Institut Curie est le centre de référence en France pour la prise en charge clinique et pour la recherche sur les tumeurs d’Ewing.
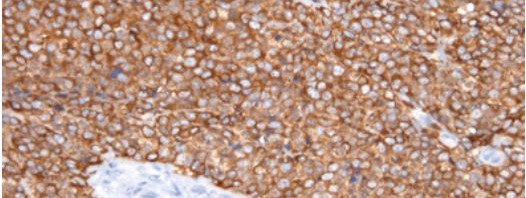
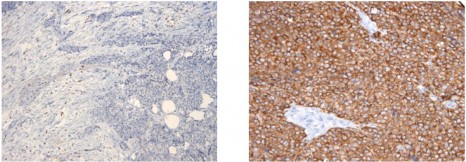
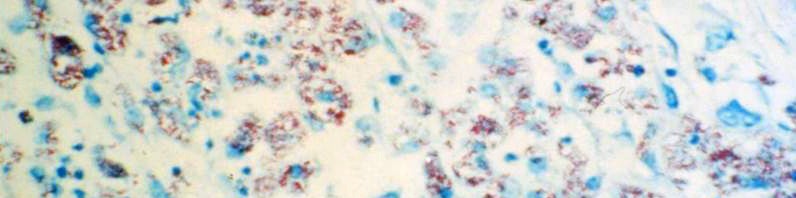
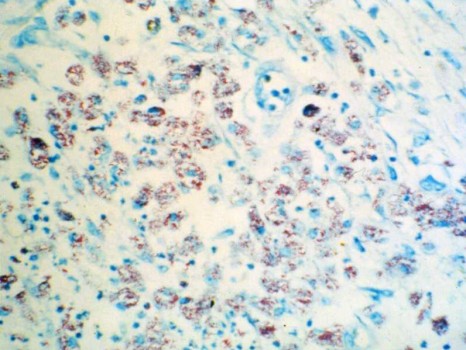
Le marquage brun sur ces deux coupes de prélèvement tumoral permet de mettre en évidence la présence de la protéine PRKCB. A gauche, il s’agit d’une tumeur desmoplastique à petite cellule ronde : dans ce cancer agressif des tissus mous, la PRKCB n’est pas exprimée. En revanche, à droite, dans une tumeur d’Ewing, la densité du marquage brun montre que la PRKCB est surexprimée, ce qui en fait un marqueur diagnostique complémentaire possible pour cette tumeur.
© AV. Decouvelaere / Centre Léon Bérard