©Adobe Stock
Que se passe-t-il dans notre cerveau lorsque nous dormons ? Pour répondre à cette question, des chercheurs français ont réalisé les premiers films de l’ensemble du cerveau du rat pendant son sommeil grâce à une technique innovante d’imagerie par ultrasons. Ils ont ainsi pu observer de façon précise le fonctionnement du cerveau des rongeurs, notamment pendant la phase de sommeil paradoxal. Ces résultats ont été obtenus dans des laboratoires communs à l’Inserm, l’ESPCI Paris, au CNRS, et à Sorbonne Université. Publiés dans Nature Communications, ils permettent de redéfinir cette période comme une phase d’hyper-synchronisation cérébrale, caractérisée par des pics massifs de débit sanguin, en particulier dans l’hippocampe. Ces nouvelles données qui questionnent le rôle attribué jusqu’à présent au sommeil paradoxal, doivent encore être confirmées chez l’être humain.
Le sommeil paradoxal est un état de sommeil particulier pendant lequel l’activité cérébrale est proche de celle de l’éveil tout en étant associée à une inhibition de l’activité musculaire. Il se caractérise notamment par des mouvements oculaires rapides et a longtemps été considéré comme uniquement impliqué dans les rêves et les processus émotionnels. Cependant, de récentes études ont montré qu’il jouait également un rôle majeur dans la plasticité neuronale de l’hippocampe, c’est-à-dire la capacité des neurones à reconfigurer leurs connexions.
Afin de mieux comprendre le fonctionnement du cerveau pendant le sommeil paradoxal, des chercheurs de l’unité Inserm 979 « Physique des ondes pour la Médecine » dirigée par Mickaël Tanter au sein de l’Institut Langevin (ESPCI Paris/CNRS) et récemment labellisée Accélérateur de recherche technologique « Ultrasons biomédicaux » en collaboration avec le laboratoire Neuroscience Paris-Seine (Sorbonne Université/CNRS/Inserm), ont étudié l’activité cérébrale chez le rat pendant son sommeil. Pour cela, ils ont couplé la technique d’électroencéphalographie (EEG), qui enregistre l’activité électrique des neurones, avec une technique d’imagerie par ultrasons ultrarapides appelée fUS (pour functional ultrasound). Cette technique innovante, développée par l’équipe de Mickaël Tanter, permet de visualiser avec une grande précision les variations des flux sanguins liés à l’activité neuronale dans l’ensemble du cerveau de rats éveillés et en mouvement.
L’équipe de recherche a observé que le sommeil paradoxal chez le rat est associé à une forte augmentation du débit sanguin dans le cerveau, se présentant sous forme de vagues qui atteignent d’abord les régions sous-corticales et se déplacent ensuite le long de l’hippocampe puis du cortex.
En comparaison, les phases de sommeil non-paradoxal et de réveil chez le rat inactif présentent des volumes sanguins cérébraux relativement bas.Cette hyperactivité vasculaire lors du sommeil paradoxal est caractérisée par deux phases : l’une proche de ce qui est observé lors d’un enregistrement chez un rat en activité, et l’autre inconnue jusqu’alors, composée d’augmentations soudaines du débit sanguin que les chercheurs ont appelées « poussées vasculaires ». Ces dernières qui durent en moyenne 5 à 30 secondes, peuvent perdurer pendant 1 minute dans les régions corticales et sont particulièrement puissantes dans l’hippocampe.
Les chercheurs ont réussi à identifier un signal électrique dans l’hippocampe (zone cruciale pour la mémoire) caractéristique de ces pics d’augmentation du débit sanguin. Ce signal – des oscillations gamma à haute fréquence – est ordinairement observé chez un rat éveillé. Leur intensité lors du sommeil paradoxal est directement corrélée à celle de la poussée vasculaire, ce qui suggère que ces oscillations locales pourraient contrôler le débit vasculaire de l’ensemble du cerveau « Cette information est cruciale, précise Antoine Bergel, co-auteur auteur de l’étude, car elle permet de cibler des régions du cerveau très précises potentiellement impliquées dans la genèse de ces événements vasculaires intenses. »
Les scientifiques ont également constaté qu’il existait, durant le sommeil paradoxal, un phénomène de synchronisation vasculaire entre des aires cérébrales éloignées les unes des autres (cortex, hippocampe, et thalamus) bien plus important que dans tout autre état de sommeil ou d’éveil.
Ces travaux présentent les tous premiers films du cerveau entier durant le sommeil paradoxal et confirment l’intérêt des ultrasons neuro-fonctionnels pour la recherche fondamentale en neurosciences. A l’heure actuelle, la technique fUS reste difficile à appliquer chez l’être humain adulte. Cependant, il est d’ores et déjà possible de confirmer ces résultats chez le nouveau-né, tout en considérant que l’extrapolation à la physiologie humaine doit se faire avec prudence. Ces résultats représentent néanmoins une avancée majeure pour la compréhension du couplage entre activité électrique et vasculaire (un phénomène impliqué dans nombre de pathologies humaines comme les accidents vasculaires cérébraux ou l’épilepsie) et questionnent notre compréhension du sommeil paradoxal, dont la fonction reste inconnue.
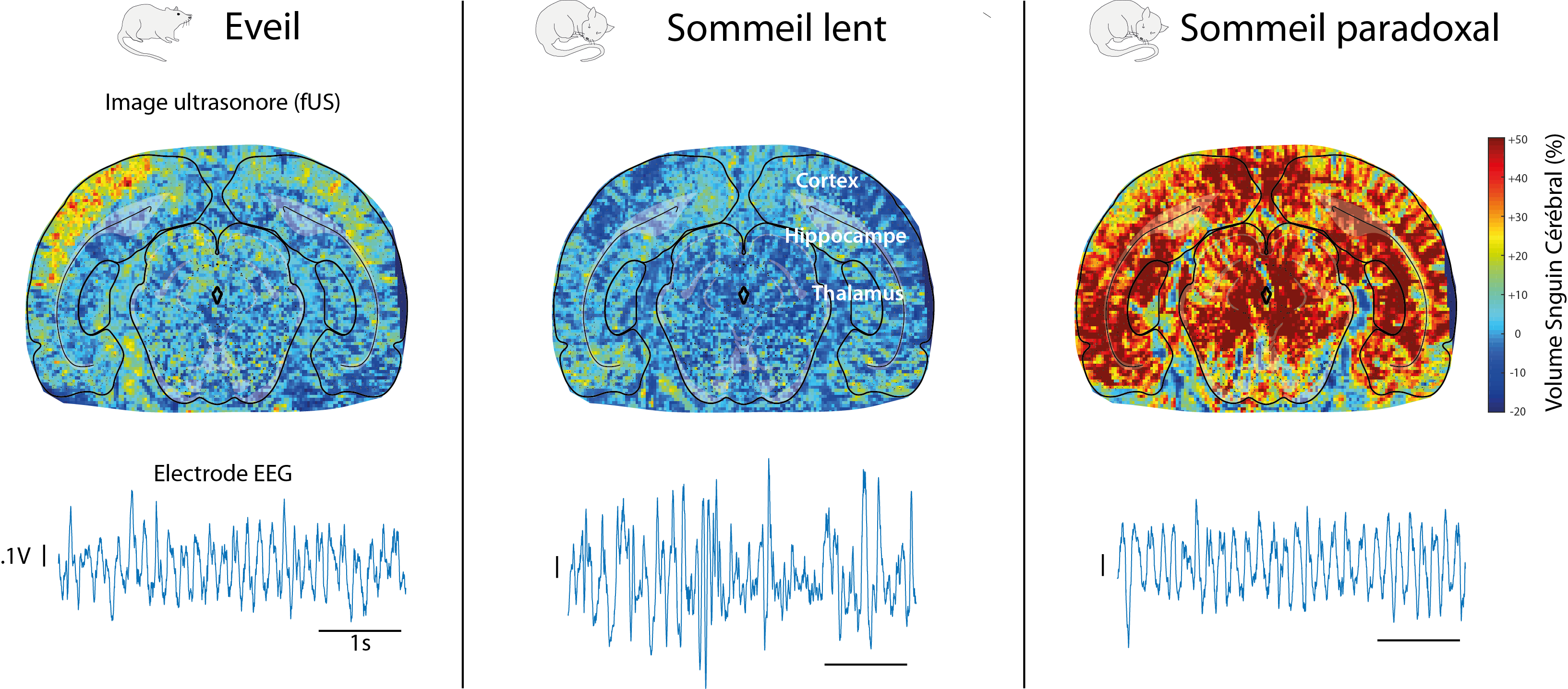
Images obtenues par la technique fUS et signaux EEG issus d’un cerveau de rat pendant l’éveil, le sommeil profond et le sommeil paradoxal. A l’inverse des signaux électriques fortement similaires entre éveil et sommeil paradoxal, l’activité vasculaire du cerveau est beaucoup plus intense et plus « synchronisée » que pendant l’éveil. Les structures cérébrales sont identifiées en superposant un atlas de cerveau aux images du réseau vasculaire.