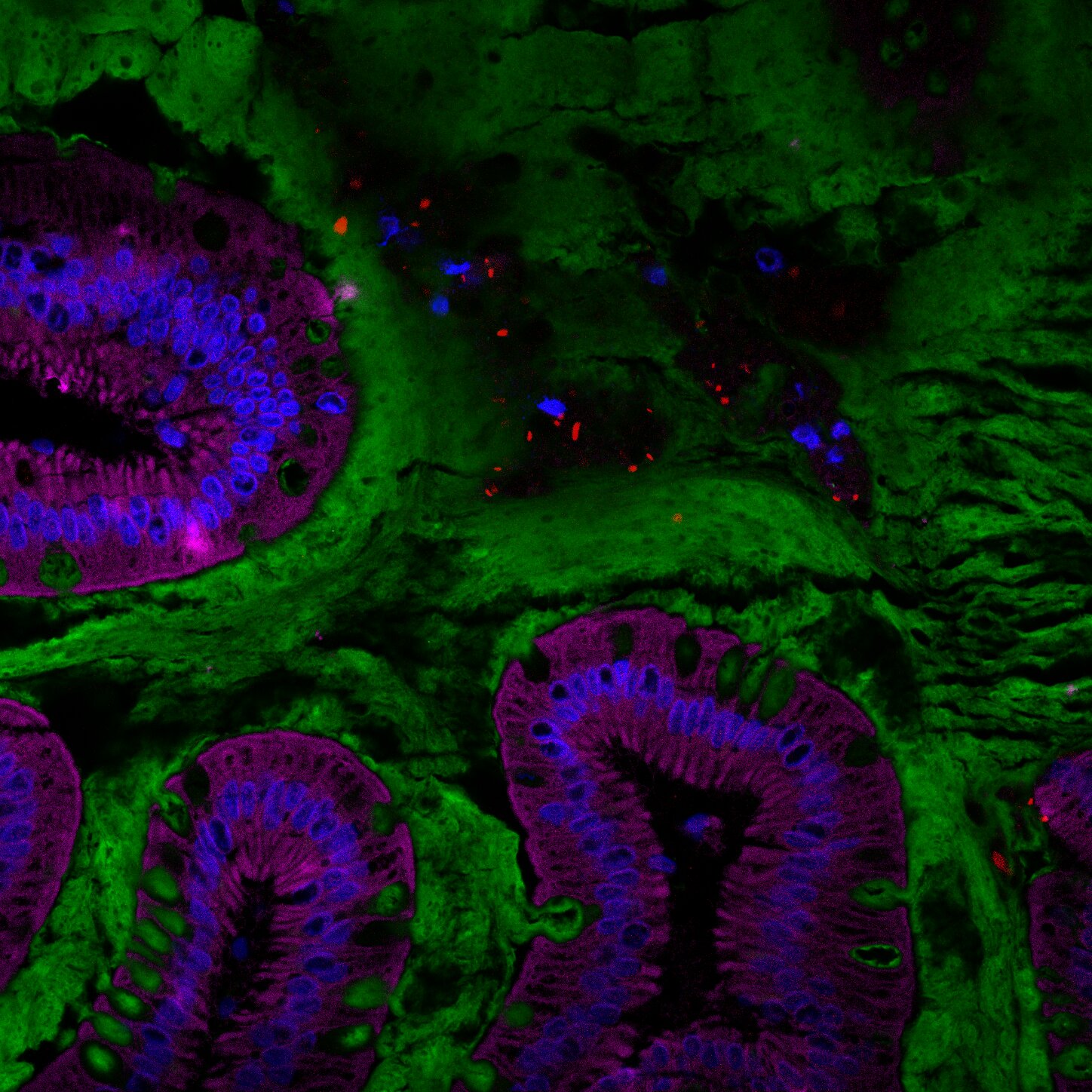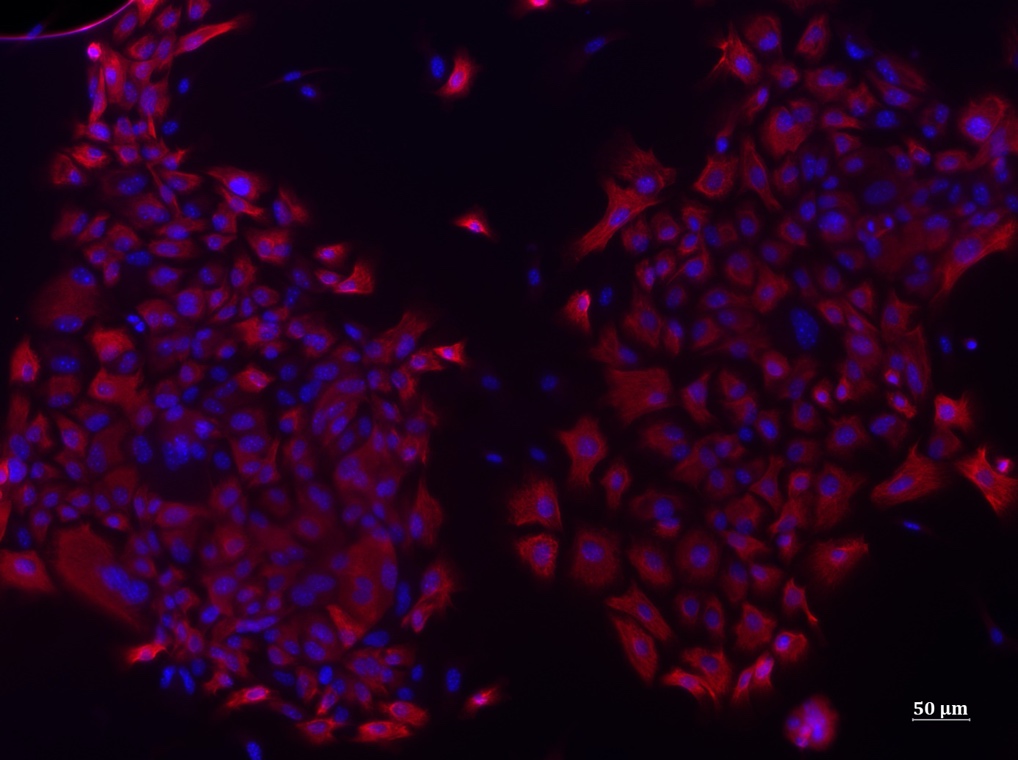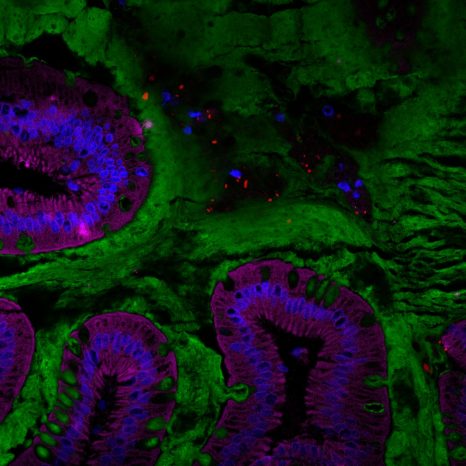
Visualisation du microbiote intestinal humain (rouge) au sein de la couche de mucus (verte) située à la surface de l’intestin. © Benoit Chassaing/Institut Cochin
Face à la prévalence importante des maladies inflammatoires chroniques de l’intestin, comme la maladie de Crohn, la recherche avance pour mieux identifier les facteurs de risque de ces pathologies et ainsi améliorer la prise en charge des patients. Des scientifiques à l’Institut Cochin (Inserm/CNRS/Université de Paris), dirigés par le chercheur Inserm Benoît Chassaing, avaient montré chez la souris que la présence d’émulsifiants alimentaires dans de nombreux plats transformés pouvait favoriser l’inflammation au niveau intestinal. Dans une nouvelle étude, publiée dans Gastroenterology, la même équipe montre aujourd’hui chez des volontaires sains, que le carboxyméthylcellulose (CMC)[1], un émulsifiant alimentaire largement utilisé, impacte l’environnement intestinal en altérant la composition du microbiote. L’équipe souligne la nécessité de travaux complémentaires pour caractériser l’impact à long terme de cet additif alimentaire, ainsi que l’étude chez des individus souffrant de maladie inflammatoire chronique de l’intestin.
Près de 20 millions de personnes dans le monde seraient touchées par les maladies inflammatoires chroniques de l’intestin, parmi lesquelles on compte la maladie de Crohn et les rectocolites hémorragiques. Des facteurs génétiques ont été identifiés pour expliquer l’inflammation de l’intestin qui caractérise ces pathologies, mais ces prédispositions ne sont pas suffisantes pour expliquer à elles seules la survenue de ces maladies. Ainsi, depuis plusieurs années, de nombreuses équipes de recherche se sont penchées sur les facteurs environnementaux.
C’est le cas du chercheur Inserm Benoît Chassaing et de son équipe à l’Institut Cochin (Inserm/CNRS/Université de Paris) qui s’intéressent à l’impact de l’alimentation – et plus spécifiquement au rôle de certains additifs alimentaires, comme les émulsifiants – sur le microbiote intestinal.
L’équipe a notamment étudié l’impact du carboxyméthylcellulose (CMC), un émulsifiant synthétique ajouté à de nombreux aliments transformés pour en améliorer la texture et prolonger leur durée de conservation. Des travaux menés sur des souris ont précédemment révélé que le CMC, ainsi que certains autres agents émulsifiants, altèrent la composition du microbiote intestinal et entraînent ainsi l’aggravation de nombreuses pathologies inflammatoires chroniques, telles que la colite, le syndrome métabolique et le cancer du côlon.
Dans de nouveaux travaux, les scientifiques ont donc cherché à vérifier si le CMC pouvait avoir le même impact chez l’humain car, bien qu’elle n’ait jamais fait l’objet de tests cliniques approfondis, cette molécule est de plus en plus utilisée dans les aliments transformés depuis les années 1960.
Étude clinique sur volontaires sains
Pour mener à bien cette étude clinique, les scientifiques ont recruté un petit groupe de volontaires sains. Les participants, logés sur le site de l’étude pendant toute sa durée, ont été divisés en deux groupes. L’un consommait un régime alimentaire strictement contrôlé et sans aucun additif, et l’autre un régime identique mais supplémenté par du CMC.
Au bout de deux semaines, les chercheurs et chercheuses ont observé que, chez les participants consommant du CMC, la composition en bactéries présentes dans l’intestin était modifiée, avec une diminution nette de la quantité de certaines espèces connues pour jouer un rôle bénéfique en santé humaine, tel que Faecalibacterium prausnitzii. De plus, les échantillons fécaux des participants recevant du CMC étaient très fortement appauvris pour de nombreux métabolites bénéfiques. Enfin, sur le plan clinique, ces participants étaient plus sujets à des douleurs abdominales et à des ballonnements intestinaux.
Des coloscopies réalisées chez ces volontaires au début et à la fin de l’étude ont également mis en évidence que chez un sous-groupe de sujets dans le groupe qui consommait du CMC les bactéries intestinales se trouvaient localisées plus proches des parois de l’intestin. Il s’agit d’une caractéristique observée dans des maladies inflammatoires de l’intestin et le diabète de type 2.
Si la consommation de CMC n’a entraîné aucune pathologie inflammatoire dans cette étude relativement courte, ces résultats confirment les données issues des études animales et suggèrent que la consommation à long terme de cet additif pourrait impacter négativement le microbiote intestinal et par conséquent favoriser les maladies inflammatoires chroniques ainsi que des dérégulations métaboliques chez l’humain.
« Nos résultats soulignent la nécessité d’études complémentaires sur cette classe d’additifs alimentaires, sur des échantillons plus larges et à plus long terme. Par ailleurs, nous souhaitons désormais mieux comprendre l’hétérogénéité des réponses au CMC entre les sujets. Pourquoi seulement certains individus développent des marqueurs inflammatoires à la suite de la consommation de ces additifs ? Certaines personnes sont-elles plus sensibles à certains additifs que d’autres ? Voici les questions auxquelles nous voulons répondre et pour lesquelles nous sommes en train de concevoir diverses approches », précise Benoît Chassaing.
L’équipe prévoit de nouvelles études cliniques et précliniques qui devraient permettre d’identifier des marqueurs moléculaires de sensibilité au CMC afin de mieux expliquer cette hétérogénéité. Des essais sur des groupes plus larges de volontaires atteints de maladies inflammatoires chroniques de l’intestin sont en cours pour identifier l’impact de l’additif chez ces patients.
[1] Le CMC est aussi désigné par E466 dans la liste des additifs notés sur les produits transformés.