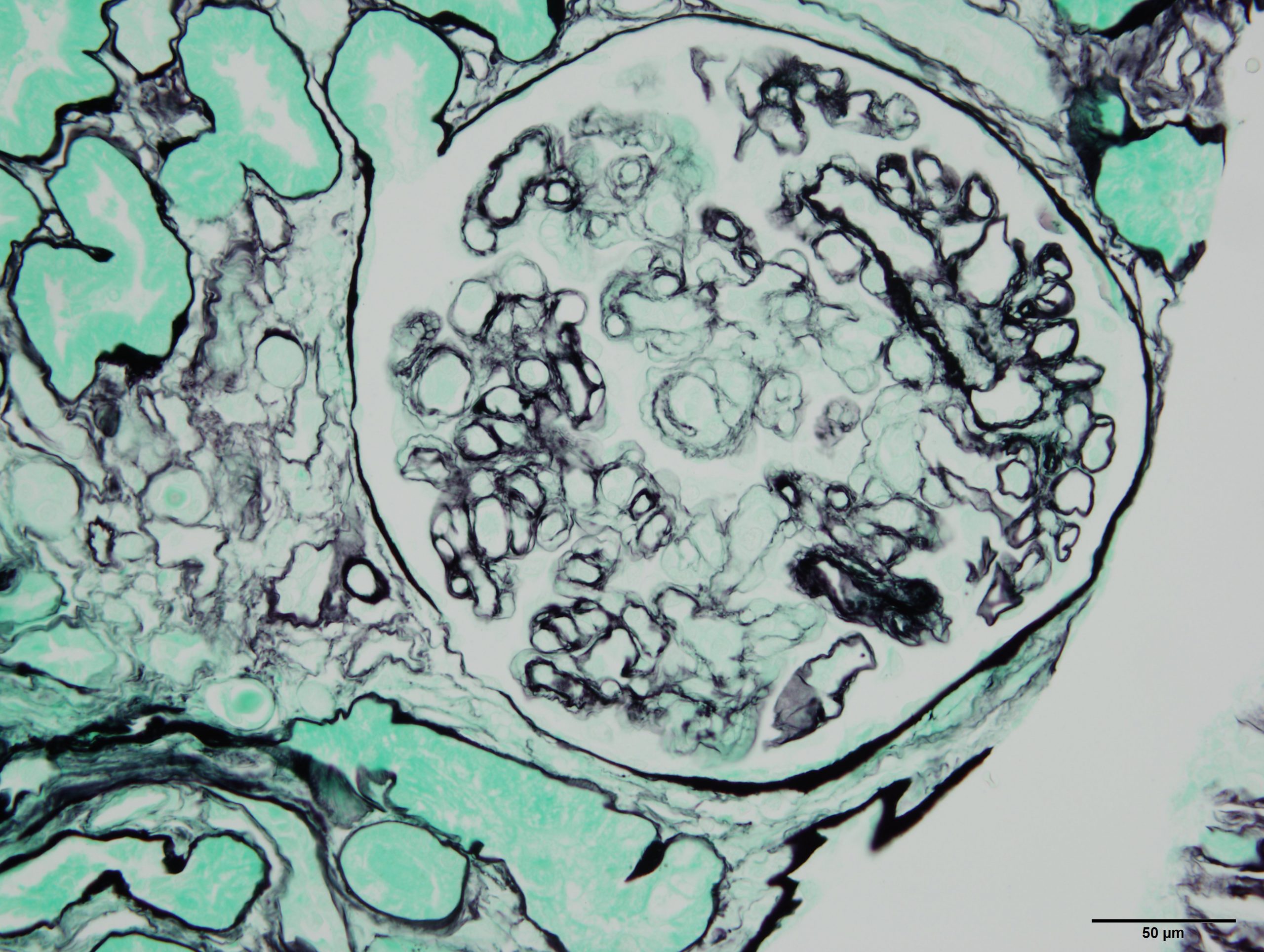
Pesée d’un enfant dépisté dans la communauté pour la malnutrition aiguë dans le cadre de l’essai clinique OptiMA-RDC, Province du Kasaï, République Démocratique du Congo.© ALIMA
Des millions d’enfants dans le monde sont touchés par la malnutrition et la crise sanitaire du Covid-19 a encore exacerbé le problème. Dans une nouvelle étude, des chercheurs et chercheuses de l’Inserm et de l’université de Bordeaux au Centre de recherche Bordeaux Population Health en collaboration avec l’IRD et l’ONG ALIMA (The Alliance for International Medical Action) ont développé et testé une nouvelle stratégie visant à simplifier et à optimiser la prise en charge de la malnutrition pour pouvoir soigner un nombre plus important d’enfants. Baptisée OptiMA, cette stratégie a fait ses preuves dans un essai clinique randomisé conduit en République démocratique du Congo (RDC), en permettant de prendre en charge 30 % d’enfants en plus tout en utilisant 20% de produits nutritionnels en moins, en comparaison avec les programmes habituels. Ces résultats sont publiés le 16 mars 2022 dans la revue The Lancet Global Health.
En 2019, la malnutrition touchait 47 millions d’enfants âgés de moins de 5 ans. Si toutes les régions du monde étaient concernées, un quart d’entre eux vivaient sur le continent africain. Après deux années de pandémie de COVID-19, qui se sont accompagnées dans de nombreux pays d’une désorganisation des systèmes de santé et d’une plus grande insécurité alimentaire, la situation est loin de s’améliorer.
A l’heure actuelle, les enfants qui souffrent de malnutrition aiguë sont soignés différemment selon qu’ils souffrent de « malnutrition aiguë sévère » ou de « malnutrition aiguë modérée » (voir encadré). Les prises en charge ne sont pas les mêmes, avec notamment l’utilisation de produits nutritionnels différents.
D’une part, dans le cas de la malnutrition aiguë sévère, on utilise des « aliments thérapeutiques prêts à l’emploi ». Les proportions données sont calculées en fonction du poids de l’enfant, c’est-à-dire que plus l’enfant évolue vers son poids normal, plus il reçoit une dose importante alors qu’il semble plus adapté de diminuer le dosage au fur et à mesure que l’enfant récupère.
D’autre part, les enfants qui souffrent de malnutrition aiguë modérée reçoivent un autre produit de composition proche, les « suppléments nutritionnels prêts à l’emploi ». Ces deux types de produits sont acheminés dans les pays concernés par différents circuits d’approvisionnement qui sont supervisés par des agences des Nations Unies distinctes pour chaque type de produit, ce qui complique la prise en charge des enfants sur le terrain. Par ailleurs, ces produits nutritionnels constituent, avec les ressources humaines, la plus grosse part des coûts liés aux programmes visant à lutter contre la malnutrition aiguë.
Alors que ces programmes font face à un manque de financement important, simplifier et homogénéiser la prise en charge pour tous les types de malnutrition est une priorité, afin de la rendre plus efficace et moins coûteuse, et in fine de soigner un plus grand nombre d’enfants. Aujourd’hui, seuls 25 % des enfants estimés en situation de malnutrition sévère sont pris en charge.
Un travail effectué main dans la main
Des chercheurs et chercheuses de l’Inserm, de l’université de Bordeaux et de l’IRD, et des professionnels de l’humanitaire de l’ONG ALIMA ont mutualisé leurs expertises respectives pour élaborer, proposer une méthodologie d’évaluation et mettre en œuvre un essai clinique destiné à évaluer une nouvelle stratégie appelée « OptiMA », dans laquelle les enfants souffrant de malnutrition aiguë, quel que soit le stade de la maladie, recevaient un unique traitement nutritionnel, les aliments thérapeutiques prêts à l’emploi, selon un dosage progressivement dégressif au fur et à mesure de la récupération nutritionnelle.
En proposant l’utilisation d’un seul type de produit pour toutes les formes de malnutrition aiguë, et en optimisant le dosage, les scientifiques espéraient pouvoir soigner les enfants plus simplement et en plus grand nombre, tout en prévenant l’évolution vers les formes les plus sévères de la malnutrition.
Leur étude, menée en République démocratique du Congo a porté sur près d’un millier d’enfants atteints de malnutrition et âgés de 6 mois à 5 ans, recrutés dans quatre aires de santé dans la province de Kasaï, regroupant une soixantaine de villages et quatre centres de santé. La méthodologie prévoyait de suivre chaque enfant pendant six mois afin de surveiller son évaluation clinique après la fin du traitement et d’évaluer le risque de rechutes.
Ce travail impliquait une visite à domicile bimensuelle de centaines d’enfants. Il a été rendu possible grâce au savoir-faire de l’ONG ALIMA, tant d’un point de vue logistique et opérationnel que pour le travail d’acceptation de ce projet de recherche et de cette nouvelle stratégie par la communauté concernée. Les expertises communes des chercheurs et des humanitaires ont permis de ne perdre de vue presque aucun enfant et donc de proposer une évaluation scientifique la moins biaisée possible de la stratégie OptiMA.
Une stratégie supérieure et moins coûteuse
Les chercheurs ont ainsi pu montrer non seulement que l’efficacité de la stratégie OptiMA n’était pas inférieure à celles des programmes classiques, mais qu’elle était même supérieure. Une prise en charge de la malnutrition aiguë basée sur un programme unique et utilisant un seul produit thérapeutique à doses progressivement réduites a conduit à un meilleur état nutritionnel des enfants et à moins de rechutes sur une période de 6 mois. Elle aboutissait en particulier chez les enfants les plus modérément atteints à une amélioration plus rapide de leur état de santé. Ils étaient également moins susceptibles de faire des rechutes pendant le suivi ou d’évoluer vers des stades plus graves de malnutrition.
Par ailleurs, le fait de n’utiliser qu’un seul produit nutritionnel à des doses optimisées a permis de réduire les coûts par enfant. Ainsi, les scientifiques démontrent que la stratégie OptiMA permettait de prendre en charge 30 % d’enfants en plus tout en utilisant 20% de produits nutritionnels en moins, en comparaison avec les programmes habituellement mis en œuvre.
« Notre stratégie permet de traiter la malnutrition de manière plus précoce, en décloisonnant la prise en charge entre malnutrition modérée et malnutrition sévère. Dans le contexte actuel, après deux années de pandémie à Covid-19, nous sommes face à un nombre croissant d’enfants malnutris et à des situations complexes dans les centres de santé en Afrique. Proposer une simplification et une optimisation des prises en charge de la malnutrition infantile est adapté au contexte mouvant dans lequel nous vivons », souligne Renaud Becquet, chercheur Inserm, co-directeur de l’équipe « Global Health in the Global South » au sein du Centre de recherche Bordeaux Population Health (Inserm/Université de Bordeaux).
La stratégie est désormais testée au Niger dans un autre essai clinique par les mêmes équipes, où elle est comparée au protocole national et à une autre stratégie simplifiée, afin de voir si ses effets bénéfiques peuvent être répliqués dans d’autres contextes et auprès d’autres populations.
Qu’est-ce que la malnutrition aiguë chez les enfants âgés de moins de 5 ans ?
La malnutrition est caractérisée par un déséquilibre entre les apports en éléments nutritifs et les besoins de l’organisme. Quand ces apports sont insuffisants, l’organisme s’affaiblit et la personne touchée perd du poids.
La malnutrition aiguë touche principalement les enfants âgés de moins de 5 ans. Elle se traduit par une perte de poids brutale et importante du fait d’apports caloriques et nutritifs insuffisants, faisant suite à une maladie infectieuse de type diarrhée, infections respiratoire, paludisme et/ou du fait d’un manque d’accès à une alimentation diversifiée et en quantité suffisante.
La malnutrition aiguë est diagnostiquée en utilisant plusieurs critères : le calcul de l’indice rapport poids/taille, la mesure du périmètre brachial (circonférence du bras mesurée entre l’épaule et le coude) ou encore la présence d’œdèmes nutritionnels. On parle ainsi par exemple de malnutrition aiguë modérée lorsqu’un enfant présente un périmètre brachial qui est compris entre 115 et 125 mm, et de malnutrition aigüe sévère lorsque ce périmètre brachial est inférieur à 115mm.
La nouvelle stratégie OptiMA propose de n’utiliser que le périmètre brachial pour dépister la malnutrition aiguë car il est simple à mesurer. Avec peu de ressources, les mères peuvent être rapidement formées à son utilisation et ainsi dépister précocement elles-mêmes la malnutrition de leurs enfants.