© Fotolia
Dans une étude publiée le 1er avril 2017 dans la prestigieuse revue Cancer Discovery, les équipes de recherche de Gustave Roussy, de l’Inserm et de l’Université Paris-Sud démontrent que l’analyse du portrait moléculaire de la tumeur cancéreuse permet d’identifier la thérapie adaptée et d’améliorer le pronostic des patients face au cancer. MOSCATO, la plus importante étude menée à ce jour en médecine de précision, le prouve pour la première fois.
L’American Association for Cancer Research (AACR) annonce également les résultats de ces travaux réalisés par des chercheurs français.
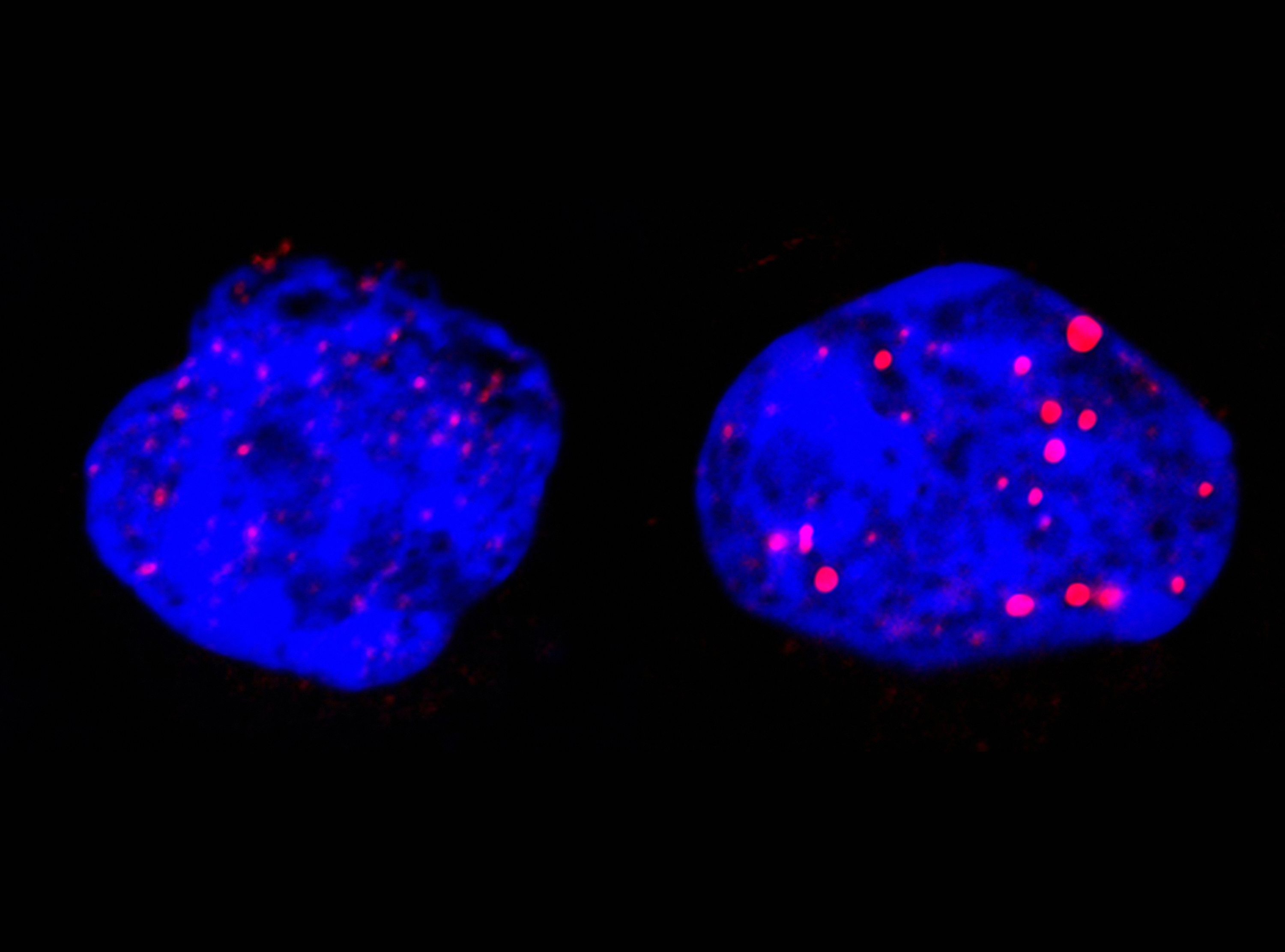
La médecine de précision réfléchit autrement la prise en charge des cancers. La tumeur n’est plus uniquement caractérisée par l’organe d’origine et par son stade d’évolution mais aussi par la nature des altérations moléculaires qu’on trouve dans son ADN ou son ARN. Une fois le portrait moléculaire dressé et les anomalies identifiées, les mutations dites actionnables orientent le choix du traitement vers la thérapie ciblée appropriée. Jusqu’à ce jour aucune étude clinique n’avait montré de bénéfice pour les patients.
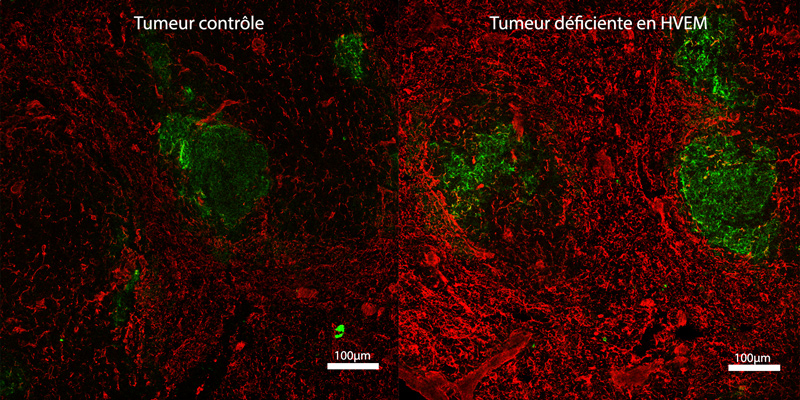
Promu par Gustave Roussy et soutenu par le programme SIRIC de l’INCa, de l’Inserm et la DGOS, MOSCATO démontre pour la première fois l’efficacité de la médecine de précision pour les patients. « Les résultats de MOSCATO sont sans appel et tranchent en faveur des analyses génomiques pour optimiser les traitements du cancer » commentent le Pr Jean-Charles Soria, Chef du Département de l’Innovation Thérapeutique et des Essais Précoces (DITEP) de Gustave Roussy/Inserm U981/Université Paris-Sud « identification de nouvelles cibles thérapeutique en cancérologie ». Il ajoute « Dans cette étude nous avons établi la carte génétique tumorale de 843 patients ce qui représente l’analyse de milliers de gènes. Chez environ la moitié des patients nous avons trouvé des mutations contre lesquelles il est possible d’agir. Au final, environ un quart des patients a pu recevoir une thérapie ciblée et chez 33 % de ces patients la thérapie ciblée a freiné la maladie ».
Pour mesurer le bénéfice clinique de la thérapie ciblée le patient était son propre témoin.
La survie sans progression de la maladie des patients sous traitement de référence pour leur pathologie étaient d’abord établie. Lorsque la maladie évoluait et lorsqu’une thérapie ciblée était administrée aux patients, la nouvelle survie sans progression de la pathologie était mesurée. Un bénéfice clinique était enregistré lorsque la survie sans progression de la maladie sous thérapie ciblée était au moins 1,3 fois plus longue que sous traitement de référence. Il faut noter, qu’avec le temps et l’enchainement des traitements, la survie sans progression de la maladie raccourcit sauf si un traitement plus efficace que les précédents est administré.
Cette étude MOSCATO (pour MOlecular Screening for Cancer Treatment Optimization) s’est déroulée à Gustave Roussy entre novembre 2011 et mars 2016. Les 1035 patients inclus présentaient différents types de cancer et leur maladie continuait de progresser malgré les traitements. Les analyses moléculaires ont été réalisées à partir de biopsies tumorales sur la plateforme hospitalière de génétique de Gustave Roussy labellisée par l’Inca. Les résultats des analyses étaient discutés en comité pluridisciplinaire composé d’oncologues cliniciens, de biologistes et de bio-informaticiens pour une prise de décision thérapeutique. Les patients avec des anomalies actionnables pouvant bénéficier de thérapies ciblées ayant déjà une AMM étaient exclus de l’étude. Les thérapies ciblées qui ont pu être proposées aux patients dans le cadre de MOSCATO étaient essentiellement évaluées en phase I (plus de 60 essais cliniques de phase I en cours à Gustave Roussy, majoritairement dans le DITEP).