La tumeur d’Ewing est un cancer osseux pédiatrique rare. Toutefois cette pathologie est plus fréquente dans les populations d’origine européenne. Olivier Delattre (1) et son équipe, David Cox (2) et Gilles Thomas (3) ont cherché à comprendre pourquoi. La réponse peut se trouver dans deux petites régions du génome : deux variants génétiques observés plus fréquemment dans les populations européennes. Les enfants porteurs d’une de ces deux variations génétiques ont un risque multiplié par deux de développer une tumeur d’Ewing. Cette découverte est publiée online dans Nature Genetics du 12 février 2012 (4).
La tumeur d’Ewing est une tumeur osseuse rare qui survient chez l’enfant, l’adolescent et le jeune adulte. Spécialiste de cette tumeur, le Dr Olivier Delattre, directeur de recherche Inserm, et son équipe à l’Institut Curie s’interrogeaient depuis de nombreuses années sur les différences d’incidence de cette tumeur selon l’origine géographique. Ils ont ainsi collaboré avec Gilles Thomas de la plate-forme Synergie Lyon Cancer et David Cox, deux chercheurs situés au Centre Léon Bérard (Lyon) pour répondre à cette question.
La plupart des tumeurs d’Ewing surviennent chez des enfants d’origine européenne et très rarement dans les populations africaines ou asiatiques. Par ailleurs, le nombre de cas dans ces deux populations reste faible même lorsqu’elles émigrent aux Etats-Unis (0,017 pour 105 individus afro-américains). « Par conséquent les facteurs environnementaux ne pouvaient pas être incriminés et il fallait chercher les raisons de cette différence dans le génome » explique Olivier Delattre.
Une telle étude génétique, sur une tumeur rare, a été possible grâce au développement de nouveaux outils, et notamment les GWAS(Genome Wide Association Study) qui permettent de dresser une cartographie des variations génétiques individuelles. L’analyse a été effectuée dans 401 prélèvements de tumeur d’Ewing, 684 prélèvements contrôles dans la population française et 3 668 dans la population américaine d’origine européenne. Sur plus de 700 000 variations génétiques observées, deux d’entre-elles (rs9430161 et rs224278) sont associées au développement de la tumeur d’Ewing. « Les enfants porteurs de ces variants génétiques ont ainsi deux fois plus de risque de développer une tumeur d’Ewing que les autres » explique David Cox. Cette augmentation du risque relatif est importante pour mieux comprendre la maladie, mais reste sans conséquence pour les porteurs de ces variants car le risque absolu reste très faible, de l’ordre de 3 cas par millions de porteurs. Or ces deux variants génétiques sont beaucoup plus rares dans les populations d’origine africaine et asiatique, expliquant en partie la faible incidence de cette pathologie dans ces populations.
Améliorer la compréhension du développement tumoral
Au-delà de l’identification des deux variants de susceptibilité, cette découverte améliore la compréhension des mécanismes cellulaires conduisant au développement des tumeurs d’Ewing. Les deux régions mises en évidence se trouvent à proximité des gènes TARDBP et EGR2. Le premier possède des similitudes avec le gène dont l’altération est à l’origine des tumeurs d’Ewing ; quant au second, il fait partie d’un groupe de gènes régulés par le gène de fusion EWS-FLI-1, responsable de cette tumeur. « Désormais, nous allons pouvoir chercher à comprendre comment ces deux gènes renforcent l’effet de l’anomalie chromosomique EWS-FLI-1 responsable de la tumeur d’Ewing » ajoute Olivier Delattre.
Le point de vue d’Olivier Delattre

© Noak/Le Bar Floreal/institut Curie
La génétique des populations pour mieux comprendre la cancérogenèse
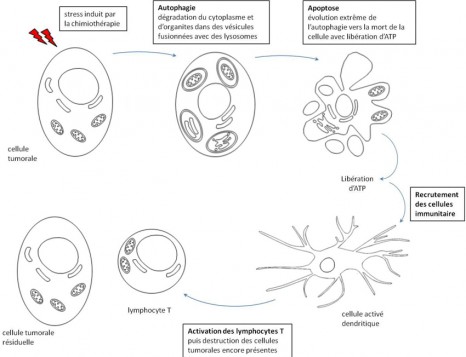
« Le matériel génétique, contenu dans le noyau de chacune de nos cellules, est une sorte de livre de 3 milliards de caractères écrit avec seulement un alphabet à 4 lettres : A, C, G, T. Même si l’enchaînement de ces caractères est quasi identique d’un individu à l’autre, il existe tout de même en moyenne 0,1 % (soit plusieurs millions) de différence entre deux individus. La diversité de la population humaine réside ainsi dans cette légère variabilité de notre séquence d’ADN. Une variation fréquente dans la population est appelée un variant. Certains variants sont associés à une pathologie : seuls ils ne présentent pas de risque, mais ils créent un terrain favorable à son développement. Il existe plusieurs moyens de rechercher de telles susceptibilités. Dans notre étude sur la tumeur d’Ewing, en raison de la forte variabilité d’une population à l’autre, la génétique des populations était la plus adaptée. Les variants ont la capacité de « moduler » l’activité de certains gènes et à ce titre, participent à la cancérogenèse. Leur connaissance améliore donc la compréhension des mécanismes tumoraux. »
Le commentaire de David Cox

© Photo Centre Léon Bérard
Application de la génomique en cancérologie
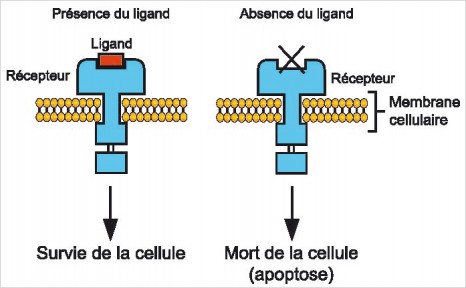
« Depuis le séquençage complet du génome humain au début des années 2000, notre capacité à explorer notre patrimoine génétique a explosé. Aujourd’hui, nous pourrions interroger plus de 5 millions de variants, des « polymorphismes », qui diffèrent d’une personne à l’autre. Ces variants sont une sorte d’enregistrement de l’histoire de l’ADN qui les entoure. Si une mutation qui augmente le risque d’une maladie survient dans une population, les variants qui l’entourent seront transmis avec la mutation pendant des générations. Comme nous ne savons pas où se trouveront ces mutations, nous utilisons ces variants pour les trouver, en comparant les fréquences des variants du génome chez des patients atteints d’une maladie, en comparaison avec des individus issus de la même population mais sains ».
Les tumeurs d’Ewing- Avec près de 100 nouveaux cas par an en France, la tumeur d’Ewing est la deuxième tumeur maligne primitive de l’os, en termes de fréquence.
- Elle survient chez l’enfant, l’adolescent et le jeune adulte (jusqu’à 30 ans), avec un pic de fréquence à la puberté. Appelée aussi sarcome d’Ewing, elle se développe essentiellement dans les os du bassin, les côtes, les fémurs, lespéronés et les tibias.
- En 30 ans, le traitement, à l’origine essentiellement basé sur la radiothérapie, a profondément évolué. Aujourd’hui, les formes localisées sont traitées majoritairement par une combinaison initiale de chimiothérapie et de chirurgie. Une chimiothérapie postopératoire, et parfois une radiothérapie, complètent le traitement. Le pronostic de la tumeur d’Ewing a bénéficié de l’apport de nouvelles chimiothérapies.
- C’est à l’Institut Curie qu’a été découverte en 1984, et caractérisée, en 1992, dans l’unité d’Olivier Delattre, l’anomalie chromosomique responsable de cette tumeur. Il s’agit d’une translocation qui se produit, dans 90 % des cas, entre les chromosomes 11 et 22 et aboutit à la synthèse d’une protéine anormale EWS-FLI-1, et dans 10 % des cas, entre les chromosomes 22 et 21 et donne lieu à la synthèse d’une protéine anormale EWS-ERG. Il existe d’autres altérations, mais elles sont rares. La découverte de ces altérations génétiques a permis la mise au point, à l’Institut Curie en 1994, d’un test diagnostic de la tumeur d’Ewing.
|
Ces recherches ont été menées dans le cadre d’une large collaboration européenne. Outre l’Inserm et l’Institut Curie, elles ont été financées par la Ligue Nationale Contre le Cancer dans le cadredu « Projet de recherche épidémiologique 2099 » et par l’INCa dans le cadre des appels à projets libres 2008 et 2009.
Par ailleurs, l’équipe du Dr Olivier Delattre reçoit également l’aide financière de l’Association des Parents et des Amis des Enfants Soignés à l’Institut Curie (APAESIC), des associations Les Bagouz à Manon, Pas du Géant, Olivier Chape, Les Amis de Claire et Courir pour Mathieu, ainsi que de la Fédération Enfants et Santé.
Sur le même sujet
L’Institut Curie est une fondation reconnue d’utilité publique associant le plus grand centre de recherche français en cancérologie et deux établissements hospitaliers de pointe. Pionnier dans de nombreux traitements, il est référent pour les cancers du sein, les tumeurs pédiatriques et les tumeurs de l’œil. Il assure la diffusion d’innovations médicales et scientifiques aux niveaux national et international. Fondé en 1909 sur un modèle conçu par Marie Curie et toujours d’avant-garde, « de la recherche fondamentale aux soins innovants », l’Institut Curie rassemble 3 000 chercheurs, médecins, soignants, techniciens et administratifs. Pour en savoir plus : www.curie.fr
Le Centre Léon Bérard est l’un des vingt Centres de lutte contre le cancer français. Basé à Lyon et reconnu comme pôle de référence de cancérologie en Rhône-Alpes, il a trois missions : les soins, la recherche et l’enseignement. Plus de 23 000 patients, venus de toute la France, sont suivis chaque année dans ses services et plateaux techniques qui proposent des traitements innovants. 1400 médecins, chercheurs, soignants, techniciens et administratifs travaillent au Centre Léon Bérard. Pour en savoir plus : www.centreleonberard.fr
Le Centre de recherche en cancérologie de Lyon (CRCL)
Le Centre de recherche en cancérologie de Lyon est une nouvelle structure de recherche créée en janvier 2011 et labellisée par l’Inserm, le CNRS, l’université Claude Bernard Lyon 1, le Centre Léon Bérard et avec pour partenaire hospitalier les Hospices Civils de Lyon. Cette structure rassemble 17 équipes de recherche, pour 370 membres dont 110 chercheurs et enseignants-chercheurs. L’activité du CRCL est tournée vers la recherche fondamentale en cancérologie, tout en ayant pour ambition de soutenir le développement d’une recherche translationnelle forte, au service des personnes malades.
L’Institut national de la santé et de la recherche médicale (Inserm) est un établissement public à caractère scientifique et technologique, placé sous la double tutelle du ministère de la Santé et du ministère de la Recherche. L’Inserm, seul organisme public de recherche français entièrement dédié à la santé humaine, s’est vu confier, en 2008, la responsabilité d’assurer la coordination stratégique, scientifique et opérationnelle de la recherche biomédicale. Ce rôle central de coordinateur lui revient naturellement par la qualité scientifique de ses équipes mais également par sa capacité à assurer une recherche translationnelle, du laboratoire au lit du patient. Pour en savoir plus : www.inserm.fr/
Notes :
(1) Olivier Delattre, directeur de l’unité Génétique et biologie des cancers – Institut Curie/Inserm U830
(2) David Cox, chargé de recherche Inserm, chercheur dans l’équipe Génétique du cancer du sein du Centre de Recherche en Cancérologie de Lyon UMR Inserm 1052 CNRS 5286 / Centre Léon Bérard / Université Lyon 1
(3) Gilles Thomas, Professeur des Universités Lyon 1 – Praticien hospitalier Hospices Civils de Lyon, directeur de la plate-forme de bioinformatique Synergie Lyon Cancer Centre Léon Bérard / Université Lyon 1 et chercheur dans l’équipe Génétique du cancer du sein du Centre de Recherche en Cancérologie de Lyon UMR Inserm 1052 CNRS 5286 / Centre Léon Bérard / Université Lyon 1
(4) “Variants at TARDBP and EGR2/ADO loci associated with Ewing sarcoma susceptibility” Nature Genetics, 12 février 2012, online