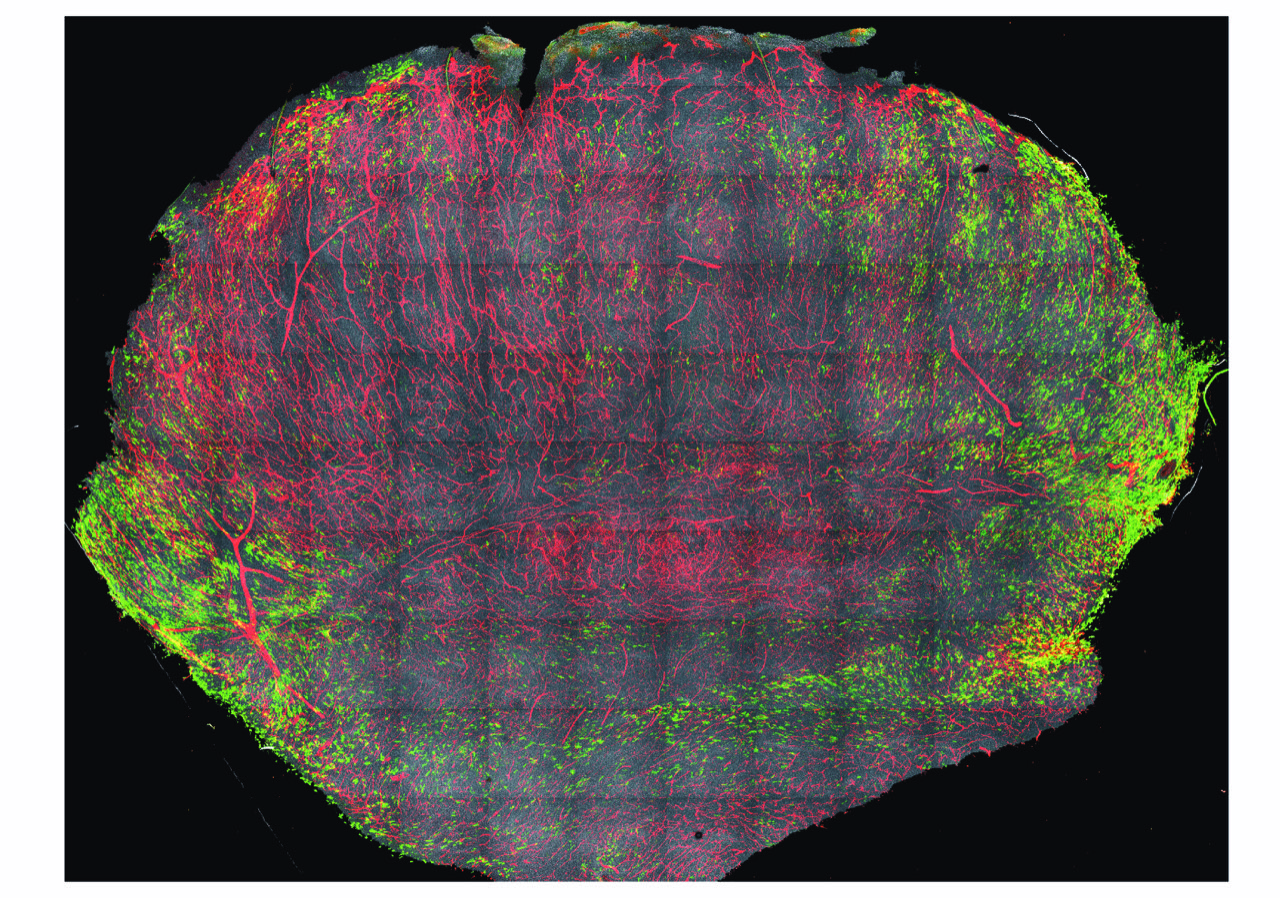
 Coupe transversale d’un mélanome avec les MTA CD163+ (macrophages associés aux tumeurs) colorés en vert, les vaisseaux sanguins colorés en rouge et le noyau des cellules coloré en gris. © 2019 Etzerodt et al.
Coupe transversale d’un mélanome avec les MTA CD163+ (macrophages associés aux tumeurs) colorés en vert, les vaisseaux sanguins colorés en rouge et le noyau des cellules coloré en gris. © 2019 Etzerodt et al.
Une équipe de l’Institut Curie, de l’Inserm et du CNRS[1] a mis en lumière un nouveau mécanisme moléculaire, jusqu’alors inconnu, liant les œstrogènes (hormones sexuelles féminines) à l’aggravation de certains cancers non classiquement considérés comme hormono-dépendants, tels que le mélanome, le cancer gastrique ou encore le cancer de la thyroïde. Ces travaux, publiés dans Nature le 11 juin 2025, ouvrent la voie à de nouvelles stratégies thérapeutiques, en particulier pour les femmes en âge de procréer.
Un rôle hormonal dans les cancers longtemps sous-estimé
Alors qu’il est admis que les cancers hormono-dépendants représentent environ 20 % des cas de cancers dans le monde[2], cette nouvelle étude questionne cet état des lieux. À partir d’une vaste analyse épidémiologique, les chercheurs ont constaté que plusieurs cancers, notamment le mélanome, sont plus fréquents chez les femmes entre la puberté et la ménopause que chez les hommes au même âge, période marquée par une forte exposition aux œstrogènes.
« Empiriquement, les dermatologues constataient déjà une incidence plus élevée de mélanomes chez les jeunes femmes, notamment après la grossesse. Nous avons cherché à comprendre scientifiquement ce phénomène », explique le Dr Lionel Larue, directeur de recherche à l’Inserm, chef d’équipe à l’Institut Curie et co-dernier auteur de l’étude.
Une boucle moléculaire pro-métastatique inédite
Les analyses menées ont permis d’identifier une voie de signalisation jusque-là inconnue, strictement dépendante de l’environnement hormonal féminin. Cette boucle de régulation implique différents acteurs moléculaires clés dont ESR1 (le récepteur aux œstrogènes) qui induit le récepteur GRPR (pour Gastrin-releasing peptide receptor), entraînant l’activation de la voie pro-métastatique YAP1[3] laquelle réprime la E-cadhérine (ECAD), une molécule d’adhésion cellule-cellule dont la diminution facilite la progression tumorale. La boucle est refermée par l’induction de la transcription de ESR1 après la réduction du niveau de ECAD.
Ainsi, ce mécanisme favorise la croissance des tumeurs, la migration et l’invasion des cellules tumorales, ainsi que leur résistance à l’anoïkis[4] – un processus un processus de mort cellulaire normalement impliqué dans la prévention de la dissémination métastatique. Et il s’agit d’un processus particulièrement actif chez les femmes, puisque dépendant de l’activation du récepteur ESR1 par les œstrogènes.
Une nouvelle cible thérapeutique prometteuse
Fait remarquable, GRPR appartient à la famille des récepteurs couplés aux protéines G (RCPG), qui représentent 35 % des cibles des médicaments actuellement approuvés, mais restent sous-exploités en oncologie. En administrant des antagonistes spécifiques de GRPR dans des modèles précliniques, les chercheurs ont observé une réduction significative de la formation de métastases. Outre son implication dans la progression tumorale, GRPR joue également un rôle dans la perception de la douleur. Sa modulation pourrait donc à la fois freiner les métastases et améliorer la qualité de vie des patientes. La mise en place de thérapies combinatoires anti-œstrogéniques pourrait constituer une approche pertinente dans le traitement des mélanomes, et d’autres cancers, présentant cette boucle métastatique.
L’âge et le sexe au cœur de la médecine personnalisée de demain
Cette découverte majeure met en évidence une nouvelle facette des inégalités de sexe face au cancer et souligne l’importance de mieux intégrer les facteurs hormonaux et biologiques dans la prévention, le diagnostic et le traitement. Elle offre également de nouvelles perspectives pour réorienter des médicaments existants vers une utilisation en oncologie.
« Mieux comprendre l’impact du sexe et de l’âge sur le développement de certains cancers est essentiel pour faire progresser la médecine de précision. Ce travail jette les bases d’approches thérapeutiques innovantes, prévalentes aux femmes, et ouvre des perspectives cliniques concrètes », conclut le Dr Lionel Larue, directeur de recherche à l’Inserm.
[1] Ces travaux ont été menés par le Dr Lionel Larue, directeur de recherche à l’Inserm, chef de l’équipe Développement normal et pathologique des mélanocytes dans l’unité Signalisation, radiobiologie et cancer (Institut Curie, Inserm, CNRS, Université Paris Saclay) et le Dr Véronique Delmas, directrice de recherche au CNRS dans la même équipe.
[2] Sung, H. et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA CANCER J CLIN 71, (2021).
[3] La voie YAP-1 est un mécanisme cellulaire essentiel qui régule la croissance et la survie des cellules. Son dysfonctionnement est impliqué dans plusieurs maladies, notamment le cancer, ce qui en fait une cible prometteuse pour de nouvelles thérapies.
[4] L’anoïkis est un processus de mort cellulaire programmée qui se produit lorsque les cellules perdent leur ancrage à leur environnement. Ce mécanisme est crucial pour le maintien de l’homéostasie tissulaire et joue un rôle important dans le développement embryonnaire, la guérison des plaies et la prévention de la formation de tumeurs.





 © Photo de
© Photo de