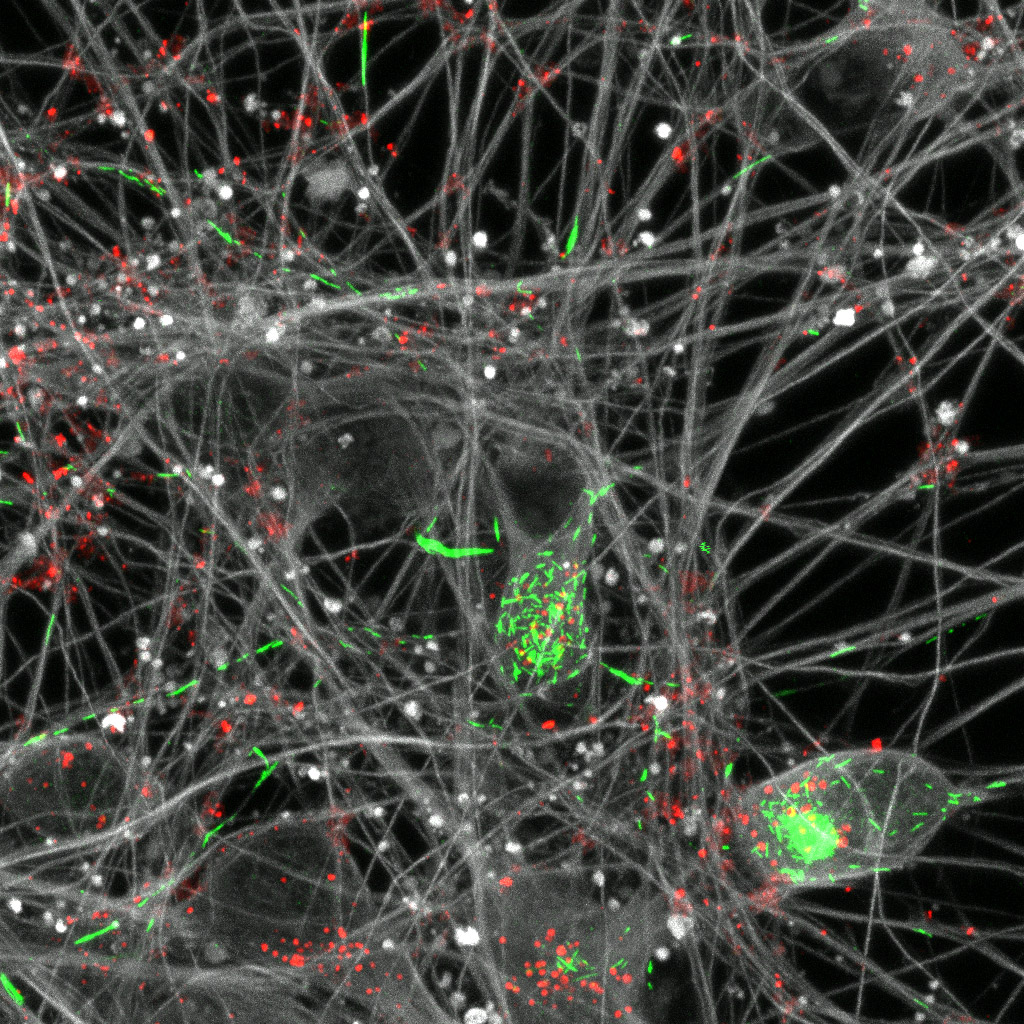
©Stéphane Marinesco / Inserm, Photographie d’un capteur chimique implantable (en bas et en noir) constitué d’une fibre de carbone platinée et recouverte d’une enzyme de reconnaissance, placé à côté d’un cheveu humain (en haut et en marron).
Une équipe de chercheurs Inserm et CNRS a réussi à développer des capteurs chimiques de nouvelle génération pour surveiller le métabolisme du cerveau, notamment lors d’accidents vasculaires cérébraux, de traumas ou de crises épileptiques. D’une taille inférieure à 15 µm, ces outils permettent de suivre ce qui se passe dans le cerveau en minimisant les lésions du tissu nerveux afin d’obtenir des données beaucoup plus fiables et représentatives des échanges neurochimiques. Ces travaux ont été publiés dans la revue ACS Central Science.
L’analyse du liquide interstitiel du cerveau peut révéler des informations chimiques importantes sur l’état du cerveau. En clinique ou chez les animaux de laboratoire, détecter, au fil du temps, les concentrations de métabolites caractéristiques de l’énergie cérébrale (comme le glucose) peut aider à déceler l’apparition de lésions cérébrales afin de permettre aux médecins d’agir avant qu’il ne soit trop tard. De plus, l’activation des réseaux neuronaux qui entraîne une libération de neurotransmetteurs peut aussi être détectée dans le fluide interstitiel. Cependant, jusqu’à présent la taille des sondes et les lésions locales dues à leur implantation étaient des paramètres qui perturbaient la qualité des mesures. La rupture des petits vaisseaux cérébraux pendant l’implantation de la sonde représente notamment un déclencheur majeur de l’inflammation. Dès l’heure qui suit l’implantation, la composition chimique locale des tissus cérébraux peut être affectée.
La première innovation présentée par les chercheurs dans ce travail a consisté à développer des capteurs miniatures.
Invisibles à l’œil nu, ils ont un diamètre inférieur à 15 microns (contre 50 à 250 microns actuellement), soit inférieur à celui d’un cheveu. L’énorme avantage d’être arrivé à miniaturiser autant les capteurs est que leur implantation ne déclenche plus de lésion au niveau des tissus nerveux. « Leur taille est inférieure à la distance moyenne entre 2 capillaires du cerveau, donc ces derniers ne sont pas endommagés par le dispositif » explique Stéphane Marinesco, chercheur Inserm en charge de l’étude.La seconde innovation a été de recouvrir les fibres de carbone par du platine puis par une couche très fine d’enzyme.
Jusqu’alors l’analyse électrochimique à l’aide de microélectrodes en fibre de carbone se limitait à un nombre très restreint de molécules dites « oxydables ». Les recouvrir de platine les rend compétentes pour y accrocher des enzymes et détecter un nombre potentiellement illimité de molécules. Pour Stéphane Marinesco, « si le dépôt de platine est une technique couramment utilisée dans le domaine de la microélectronique, elle est généralement réalisée avec des substrats plats en silicium. Nos résultats montrent que, malgré leur géométrie cylindrique inhabituelle, les fibres de carbone peuvent être recouvertes avec succès par une couche de platine. La sensibilité obtenue est similaire ou meilleure que celle des fils en platine massif plus épais qui sont disponibles sur le marché. »Quand ces capteurs ont été implantés dans les cerveaux de rats lors de tests en laboratoire, aucune blessure au niveau des tissus ou des vaisseaux sanguins cérébraux n’a été détectée.
De plus, ces microélectrodes ont fourni des évaluations des taux de glucose, lactate et des concentrations d’oxygène plus fiables et plus précises en comparaison des capteurs conventionnels (ici un capteur est nécessaire pour chaque paramètre en implantant un « peigne » avec plusieurs microélectrodes). De nombreux tests ont été réalisés sur ces nouvelles microélectrodes notamment sur leur stabilité dans le temps puisqu’elles ont également été testées après 6 mois de stockage (température ambiante dans l’obscurité).Stéphane Marinesco précise que : « Ce dispositif peu envahissant représente une avancée majeure dans notre capacité d’analyser le liquide interstitiel cérébral, ouvrant la voie à la mesure de nouveaux paramètres physiologiques et à de multiples applications. Ce nouvel outil pourrait être utilisé pour tester l’effet de certains médicaments sur le cerveau. Enfin, à plus long terme, le monitoring du cerveau humain pourrait fournir de précieuses informations aux médecins pour mieux comprendre comment un patient atteint de lésions cérébrales récupère après un traumatisme crânien ou un accident vasculaire cérébral. Ce dispositif pourrait également les aider à prendre les meilleures décisions thérapeutiques en fonction de l’évolution du patient ».