Une équipe de chercheurs français du CEA, de l’AP-HP, du CNRS, de l’Inserm, de l’Inra, de l’ENVT, de l’Institut Pasteur et de MacoPharma a montré que de multiples variants de prions peuvent coexister et se manifester sous différentes formes cliniques selon les conditions de transmission. Les résultats de cette étude sont publiés dans Nature Communications, le 2 novembre 2017.
Moins de 250 cas de variante de la maladie de Creutzfeldt-Jakob (v-MCJ) ont été recensés dans le monde, principalement au Royaume Uni, suite à l’exposition des populations humaines à l’agent de l’Encéphalopathie Spongiforme Bovine (ESB, ou maladie de la vache folle). Cependant, plus de 99 % des infections humaines par ces prions d’origine bovine pourraient demeurer silencieuses selon des études britanniques menées sur des prélèvements d’appendices, ce qui suggère un risque de transmission inter-humaine lié à de tels porteurs apparemment sains, notamment par la voie de la transfusion sanguine.
Evaluation du risque transfusionnel
Dans le cadre de l’évaluation du risque transfusionnel lié à la v-MCJ, les chercheurs du CEA, de l’hôpital universitaire La Pitié-Salpêtrière, de l’AP-HP, du CNRS, de l’Inserm, de l’Inra, de l’ENVT, de l’Institut Pasteur et de MacoPharma[1] ont exposé des souris et des macaques à des produits sanguins issus de donneurs infectés par la v-MCJ.
Au moyen des techniques classiquement utilisées pour le diagnostic des maladies à prion (histologie, biochimie), les chercheurs ont relevé peu de cas de transmission de la v-MCJ sous sa forme classique (moins de 3 % des animaux exposés). Ces cas ont été principalement observés lorsque les donneurs étaient fortement infectés, ce qui correspond à la situation observée chez l’homme[2].
Observation de myélopathies
En revanche, précise Emmanuel Comoy, chercheur au CEA et auteur principal, « dans une proportion nettement plus importante (2 à 5 fois plus selon les modèles étudiés, soit près de 10 % des animaux exposés), des animaux receveurs ont développé des syndromes neurologiques fatals différents de la v-MCJ ».
Ces syndromes ne présentent pas l’ensemble des caractéristiques classiques des maladies à prion (formation de vacuoles dans le cerveau et accumulation d’une forme anormale de la protéine du prion[3] résistante à la dégradation par des enzymes). Ils sont désignés sous le terme de myélopathies chez les primates affectés car ils sont principalement centrés sur la moelle épinière. Ces syndromes se révèlent bien faire partie des maladies à prion, puisque leur retransmission aux souris conduit à l’apparition des caractéristiques classiques des maladies à prions.
Infection par des porteurs sains
La forme myélopathique de la maladie a été observée chez des animaux transfusés avec du sang provenant de porteurs apparemment sains, c’est-à-dire de donneurs exposés aux prions et sans pathologie identifiable, ainsi qu’à partir de sang provenant de patients présentant les signes cliniques de la v-MCJ.
L’étude révèle ainsi une diversité de syndromes, du porteur sain à la forme typique de v-MCJ : de multiples variants de prions pourraient donc coexister et émerger sous différentes formes cliniques selon les conditions de transmission (voie d’exposition, dose, nature du produit contaminant, état agrégé ou dispersé des prions).
Dans un contexte où l’exposition humaine par voie alimentaire à l’agent de l’ESB a pu entraîner l’émergence de nombreux porteurs apparemment sains, les chercheurs relèvent que leur étude, qui remet en question l’unicité de la souche d’ESB/v-MCJ, souligne la difficulté à détecter et prévenir la transmission de toutes les formes d’infections à prions. Ces questions font actuellement l’objet d’investigations complémentaires.
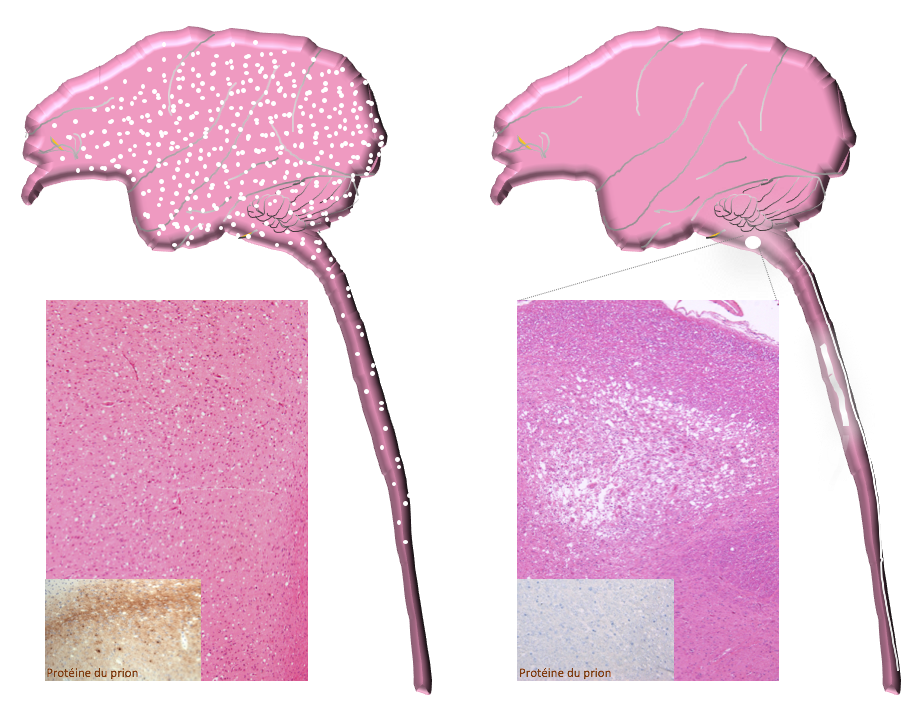
Comparaison des lésions observées : Les macaques développant une v-MCJ présentent une vacuolisation et une accumulation de la protéine du prion anormale dans l’ensemble du système nerveux (figure de gauche), tandis que les lésions chez les macaques myélopathiques sont focalisées dans la moelle cervicale basse et le tronc cérébral, sans accumulation de protéine prion anormale détectable par les techniques classiques (figure de droite). © CEA/E. Comoy.
[1] Institut François Jacob (CEA), Institut du cerveau et de la moelle épinière (CNRS/Inserm/UPMC/ Hôpital Universitaire Pitié-Salpêtrière, AP-HP), l’Institut Neuromyogène (CNRS/Inserm/Univ. Cl. Bernard Lyon 1/ Hospices Civils de Lyon), laboratoire Interactions hôtes-agents pathogènes (Inra/ENVT), société Maco-Pharma, unité de Biologie des infections (Institut Pasteur), Laboratoire de maladies neurodégénératives : mécanismes, thérapies, imagerie (CNRS/CEA/Univ. Paris Sud).
[2] Durant les dix dernières années, 4 cas de contamination par l’agent de la v-MCJ au Royaume-Uni sont imputés à transfusion de produits sanguins non déleucocytés (sang dit « total », dont les globules blancs n’ont pas été retirés) dérivés de donneurs qui ont développé eux-mêmes une v-MCJ peu de temps après leur don. A présent les produits sanguins sont systématiquement déleucocytés.
[3] Un prion pathologique est un agent pathogène constitué d’une protéine dont la conformation ou le repliement est anormal et qui, au contraire d’agents infectieux tels que les virus ou les bactéries, ou encore des parasites, ne dispose pas d’acide nucléique (ADN ou ARN) comme support de l’information infectieuse.