© L. Peris /GIN
Après 40 ans de recherche, des chercheurs du CEA, du CNRS, de l’Université Grenoble Alpes, de l’Université de Montpellier et de l’Inserm ont enfin démasqué l’enzyme responsable de la détyrosination de la tubuline. Surprise : ce n’est pas une enzyme mais deux qui ont été découvertes capables de modifier ce composant essentiel du squelette de la cellule. Ces travaux ouvrent de nouvelles pistes pour mieux comprendre le rôle de la tubuline dont les altérations accompagnent cancers, maladies cardiaques et défauts neuronaux. Ces résultats sont publiés le 16 novembre 2017 dans la revue Science.
Une collaboration internationale impliquant des chercheurs du CEA, du CNRS, de l’Inserm, de l’Université Grenoble Alpes, de l’Université de Montpellier et de l’Université de Stanford[1] a identifié une enzyme, la Tubuline CarboxyPeptidase (TCP), qui est responsable d’une transformation biochimique des microtubules cellulaires, la détyrosination. La détyrosination est une réaction biologique consistant à supprimer l’acide aminé terminal tyrosine[2], de la tubuline α, un composant des microtubules. Alors qu’elle était recherchée depuis quatre décennies, les biologistes ont réussi à isoler cette protéine par purification et ont ensuite apporté les preuves de son activité cellulaire.
Les microtubules contribuent à des fonctions cellulaires essentielles
Les microtubules sont des fibres dynamiques présentes dans toutes les cellules. Formés par l’assemblage de deux protéines (tubuline α et tubuline β), les microtubules assurent de nombreuses fonctions. Ils séparent les chromosomes destinés aux deux cellules filles lors de la division cellulaire, ils contribuent à la polarité des cellules, à la morphologie et à la migration cellulaire. Ils forment des sortes de rails sur lesquels sont transportés des constituants cellulaires tels que des protéines ou des brins d’ARN.
Ces fonctions cellulaires sont régulées grâce à l’existence de « signaux » présents à la surface des microtubules. Ces signaux sont des modifications biochimiques des acides aminés (appelées modifications post-traductionnelles car elles ont lieu après la synthèse de la protéine) qui sont réalisées par plusieurs enzymes qui, ici, modifient les tubulines.
L’enzyme TCP, identifiée après 40 ans de mystère
L’activité de l’une de ces enzymes a été mise en évidence pour la première fois en 1977 par des chercheurs argentins qui lui donnent le nom de TCP (Tubuline CarboxyPeptidase). Cette enzyme, qui n’avait jusqu’à ce jour jamais été identifiée (sa taille et sa séquence restaient inconnues), a comme fonction de supprimer le dernier acide aminé, une tyrosine, de l’extrémité de la tubuline α. C’est la réaction de détyrosination. Une enzyme réverse, la ligase TTL, est chargée de repositionner cette tyrosine à sa place. C’est la tyrosination. Ce cycle de détyrosination/tyrosination est vital pour la cellule et l’organisme. Une détyrosination massive (anormale) est observée dans plusieurs cancers sévères et maladies cardiaques.
Identifier et caractériser la TCP constituait donc un objectif majeur pour comprendre la fonction physiologique de la détyrosination de la tubuline α et pour évaluer les conséquences de son inhibition.
Pour isoler la TCP, les chercheurs ont suivi son activité, utilisé des techniques classiques de biochimie et fait appel à des chimistes de l’Université de Stanford qui ont développé une petite molécule inhibitrice de son activité. Cette molécule a été utilisée comme hameçon pour « pêcher » l’enzyme convoitée.
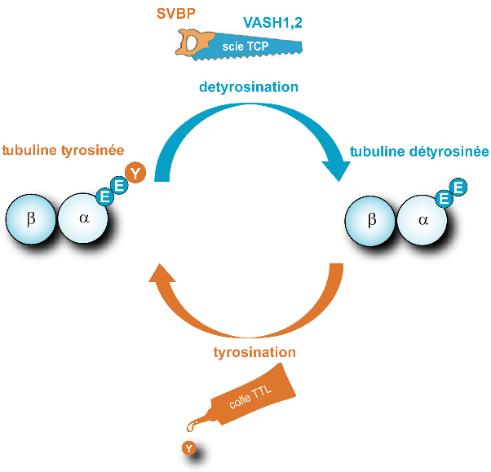
Cycle de détyrosination/tyrosination de la tubuline
Les microtubules sont des fibres présentes dans toutes les cellules composées d’un empilement de tubulines α/β. La tubuline α porte une tyrosine (Y) à son extrémité qui est alternativement enlevée et replacée par deux enzymes, modifiant ainsi la surface des microtubules. La TCP (représentée par une scie composée de deux éléments, VASH/SVBP) est responsable de la détyrosination. La TTL (représentée par un tube de colle) replace la tyrosine sur la tubuline. Ce cycle est essentiel aux diverses fonctions des microtubules dans les cellules (division, migration, …) et vital pour l’organisme. © C. Bosc, GIN
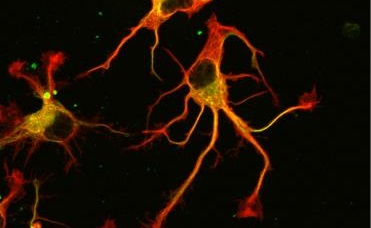
Au final, ce ne sont pas une, mais deux enzymes qui ont été découvertes ! Ces dernières, dénommées VASH1 et VASH2, étaient déjà connues des scientifiques mais sans savoir qu’il s’agissait d’enzymes en lien avec le cytosquelette. Les chercheurs ont montré qu’à la condition d’être associées à une protéine partenaire appelée SVBP, VASH1 et VASH2 sont capables de détyrosiner la tubuline α. Pour le démontrer, les chercheurs ont supprimé leur expression (ou celle de leur partenaire SVBP) dans les neurones. Ils ont alors observé une très forte diminution du taux de détyrosination de la tubuline α, ainsi que des anomalies dans la morphologie des neurones (v. Figure). Les chercheurs sont allés plus loin en montrant que ces enzymes sont également impliquées dans le développement du cortex cérébral.
Des perspectives pour la lutte contre le cancer
Ainsi, quarante ans après les premiers travaux sur la détyrosination de la tubuline α, les enzymes responsables ont été démasquées ! Dorénavant, les scientifiques espèrent qu’en modulant l’efficacité de la TCP et en améliorant les connaissances du cycle détyrosination/tyrosination, ils pourront mieux lutter contre certains cancers et progresseront dans la connaissance des fonctions cérébrales et cardiaques.
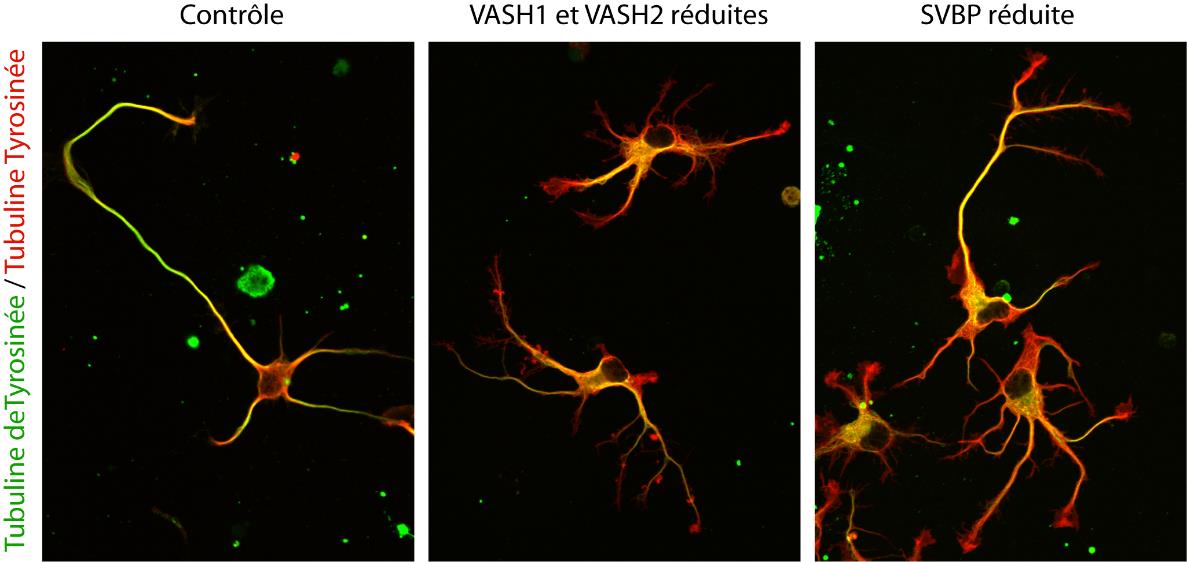
Photographies de l’altération des neurones par une réduction de l’expression des enzymes TCP (VASH/SVBP. De gauche à droite : neurone contrôle, neurones dans lesquels l’expression de VASH1 et VASH2 est réduite, neurones dans lesquels l’expression de SVBP est réduite. Les neurones ayant moins d’enzyme présentent un retard de développement et des anomalies morphologiques. © L. Peris /GIN
[1] Les instituts suivants sont impliqués : Grenoble Institut des neurosciences, GIN (Inserm/Univ. Grenoble Alpes); l’Institut de biosciences et biotechnologies de Grenoble, BIG (Inserm/CEA/Univ. Grenoble Alpes) ; l’Institut pour l’avancée des biosciences, IAB (Inserm/CNRS/Univ. Grenoble Alpes), le Department of Pathology, Stanford University School of Medicine (Stanford, USA), l’Institut de génétique humaine, IGH (CNRS/Univ. de Montpellier), le Centre de recherche en biologie cellulaire de Montpellier, CRBM (CNRS/Univ. de Montpellier).
[2] La tyrosine est l’un des 22 acides aminés qui constituent les protéines