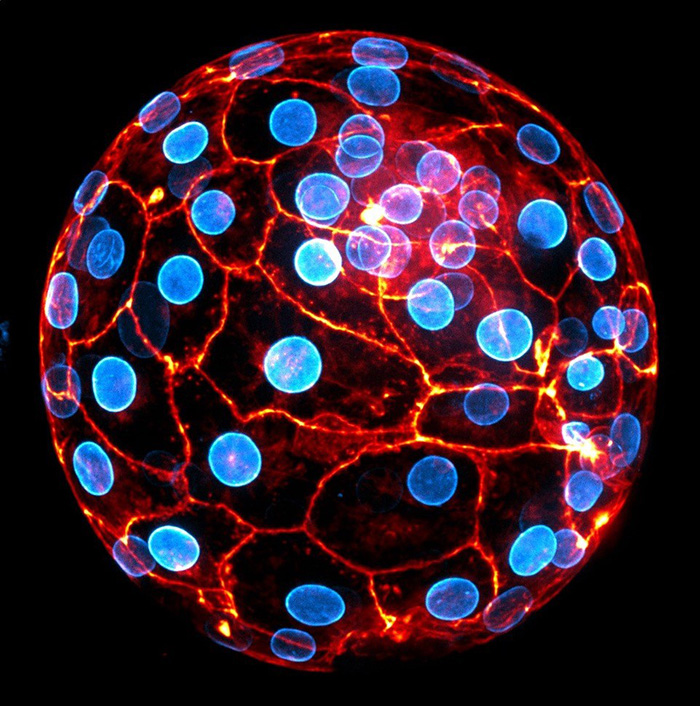
Connues pour jouer un rôle clé dans le développement de nombreux tissus, les cellules de la crête neurale (image ci-dessus) seraient au cœur des mécanismes de régénération chez les mammifères, selon les scientifiques. © Jholy De la cruz / Inserm
Connues pour jouer un rôle clé dans le développement de nombreux tissus, les cellules de la crête neurale (image ci-dessus) seraient au cœur des mécanismes de régénération chez les mammifères, selon les scientifiques. © Jholy De la cruz / Inserm
Seuls quelques animaux dans le monde possèdent la capacité de régénérer des tissus, ce qui leur permet de faire repousser des morceaux de membres ou des membres entiers après amputation. Dans une étude publiée dans la revue PNAS, une équipe de recherche de l’Inserm, de l’Université de Montpellier et du CHU de Montpellier montre que des embryons de souris cultivés en laboratoire ne peuvent initier la régénération des bourgeons de membres antérieurs, tels que les pattes avant, que durant une période extrêmement courte : entre 10,5 et 12,5 jours après la fécondation, au moment où les bourgeons de membres commencent tout juste à se former. En dehors de cette fenêtre, cette capacité disparaît complètement. Les scientifiques démontrent que ce phénomène repose sur une population spécifique de cellules de la crête neurale, connues pour jouer un rôle clé dans le développement de nombreux tissus. Leurs résultats suggèrent que ces cellules sont au cœur des mécanismes de régénération chez tous les vertébrés. L’équipe a également réussi à induire la régénération après une amputation en transplantant ces cellules dans un embryon qui en était dépourvu et avait perdu sa capacité de régénération. Cette étude réalisée dans le cadre du programme de recherche Biothérapies et bioproduction de thérapies innovantes marque une nouvelle étape vers une médecine régénératrice, capable de restaurer les tissus biologiques et leurs fonctions.
Contrairement aux lézards et aux salamandres dont la queue peut repousser, la régénération de tissus est très limitée chez les mammifères. Il existe néanmoins quelques exceptions bien connues : les cerfs renouvellent leurs bois chaque année, et les lapins sont capables de réparer des tissus excisés dans leurs oreilles.
Une autre exception notable concerne les embryons de souris. Une précédente étude[1] a montré que chez ces derniers, la régénération de bourgeons de membres antérieurs (les pattes avant) est possible au cours de la dixième journée après la fécondation. En revanche, on ignorait jusqu’ici combien de temps cette faculté persistait et quels mécanismes biologiques et cellulaires la rendaient possible.
Une nouvelle étude réalisée dans le cadre du programme de recherche Biothérapies et bioproduction de thérapies innovantes, financé par le plan d’investissement France 2030, piloté par l’Inserm et le CEA apporte aujourd’hui des réponses à ces questions. Publiés dans la revue PNAS, ces travaux ont été dirigés par une équipe de recherche de l’Inserm, de l’Université de Montpellier et du CHU de Montpellier.
« Notre découverte montre que les embryons de souris ne peuvent initier la régénération des bourgeons de membres antérieurs que durant un laps de temps extrêmement étroit du développement : entre 10,5 et 12,5 jours après la fécondation, au moment où les bourgeons commencent tout juste à se former, explique Farida Djouad, dernière autrice de cette étude. En dehors de cette période, cette capacité disparaît complètement. »
Concrètement, les scientifiques ont amputé le bourgeon de membre antérieur d’embryons de souris cultivés en laboratoire 10,5 jours après la fécondation, et ont observé que le bourgeon commençait à se régénérer au cours des 24 heures suivantes. En revanche, lorsque la même expérience était réalisée 12,5 jours après la fécondation, aucune régénération n’était constatée.
L’étude révèle que cette faculté repose sur une population spécifique de cellules appelées cellules issues de la crête neurale, connues pour jouer un rôle clé dans le développement du système nerveux, du squelette du visage et de nombreux tissus.
Au cours des trois heures suivant l’amputation, ces cellules migrent vers la zone lésée et participent à la formation d’un blastème, un amas de cellules immatures à l’origine de la repousse. « Lorsque ces cellules sont absentes, la régénération échoue. Mais si on les transplante à nouveau, cette faculté semble pouvoir être restaurée », souligne Farida Djouad.
Grâce à des puces à ADN permettant d’analyser l’activité de milliers de gènes simultanément, les scientifiques ont montré que les gènes bmp4 et fgf8, marqueurs spécifiques activés lors de la formation des membres dès le stade embryonnaire, étaient perdus après amputation mais réactivés lors de la régénération, soulignant leur rôle essentiel dans la restauration des structures amputées.
D’autres gènes, WNT1 et FOXD3, caractéristiques des cellules de la crête neurale et normalement actifs à un stade encore plus précoce chez l’embryon (entre le 8ᵉ et le 10ᵉ jour après la fécondation, au moment où les bourgeons de membres commencent à se former), étaient également réactivés. « Cette réactivation temporaire semble permettre aux cellules de retrouver un état plus jeune et plus flexible, capable de se mobiliser et de participer à la reconstruction des tissus », poursuit la dernière autrice.
De précédentes études avaient déjà mis en évidence le rôle des cellules issues de la crête neurale lors de la régénération de queues ou de membres chez les tritons[2], ainsi que dans la régénération de l’extrémité des doigts chez des embryons de souris[3].
« Nos résultats suggèrent que les cellules issues de la crête neurale sont au cœur des mécanismes de régénération chez tous les vertébrés, des amphibiens aux mammifères », explique Jholy De La Cruz, co-premier auteur de l’étude.
Ces résultats offrent un début d’explication à la perte de la faculté de régénération chez les souris adultes : les cellules issues de la crête neurale sont présentes, mais elles ne peuvent plus réactiver les gènes nécessaires à la régénération des tissus exprimés à l’état embryonnaire.
L’équipe de recherche souhaite maintenant savoir si ces mécanismes existent aussi chez l’humain.
« À terme, nous espérons que nos travaux contribueront à mieux comprendre la régénération des tissus, y compris chez les humains, et comment il pourrait un jour être possible de réactiver ces mécanismes à des fins thérapeutiques », conclut Farida Djouad.
[1]Chan WY, Lee KK, Tam PP. Regenerative capacity of forelimb buds after amputation in mouse embryos at the early-organogenesis stage. J Exp Zool. 1991 Oct;260(1):74-83. doi: 10.1002/jez.1402600110. PMID: 1791423.
[2] Kumar A, Godwin JW, Gates PB, Garza-Garcia AA, Brockes JP. Molecular basis for the nerve dependence of limb regeneration in an adult vertebrate. Science. 2007 Nov 2;318(5851):772-7. doi: 10.1126/science.1147710. PMID: 17975060; PMCID: PMC2696928.
[3] Johnston AP, Yuzwa SA, Carr MJ, Mahmud N, Storer MA, Krause MP, Jones K, Paul S, Kaplan DR, Miller FD. Dedifferentiated Schwann Cell Precursors Secreting Paracrine Factors Are Required for Regeneration of the Mammalian Digit Tip. Cell Stem Cell. 2016 Oct 6;19(4):433-448. doi: 10.1016/j.stem.2016.06.002. Epub 2016 Jul 1. PMID: 27376984.

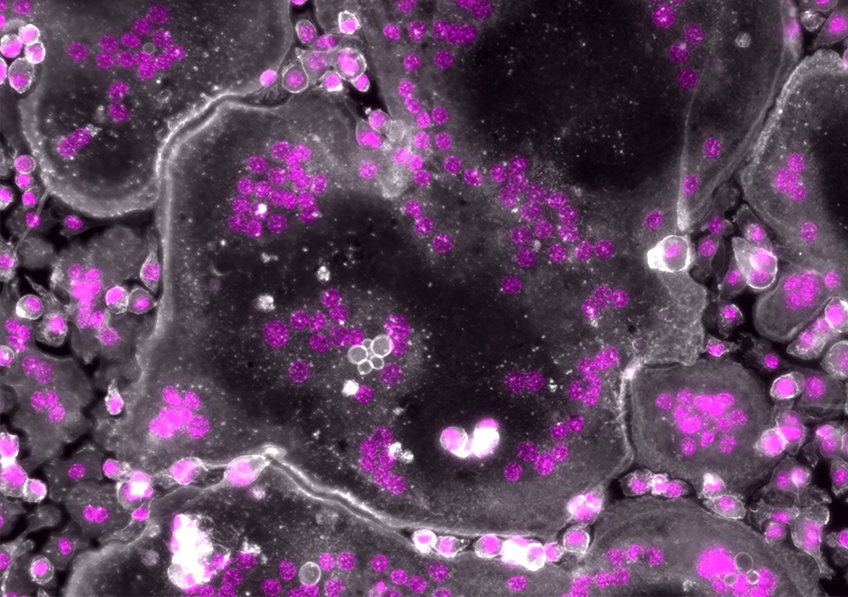
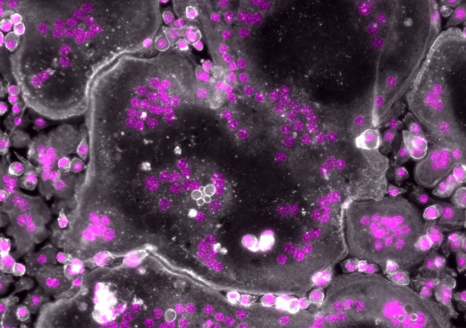 En l’absence de moésine, les ostéoclastes humains présentent des noyaux surnuméraires (en rose). L’actine est représentée en blanc. – Microscopie à fluorescence © Ophélie Dufrançais
En l’absence de moésine, les ostéoclastes humains présentent des noyaux surnuméraires (en rose). L’actine est représentée en blanc. – Microscopie à fluorescence © Ophélie Dufrançais