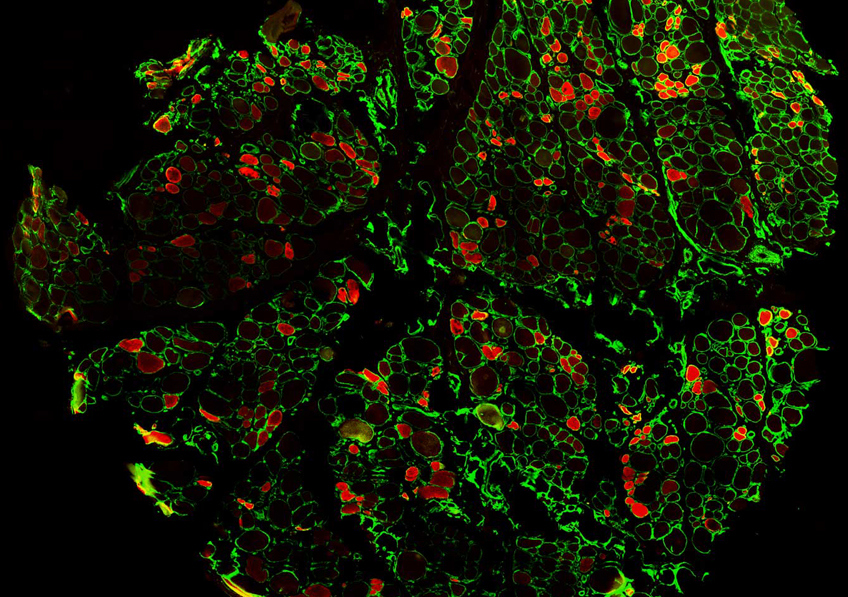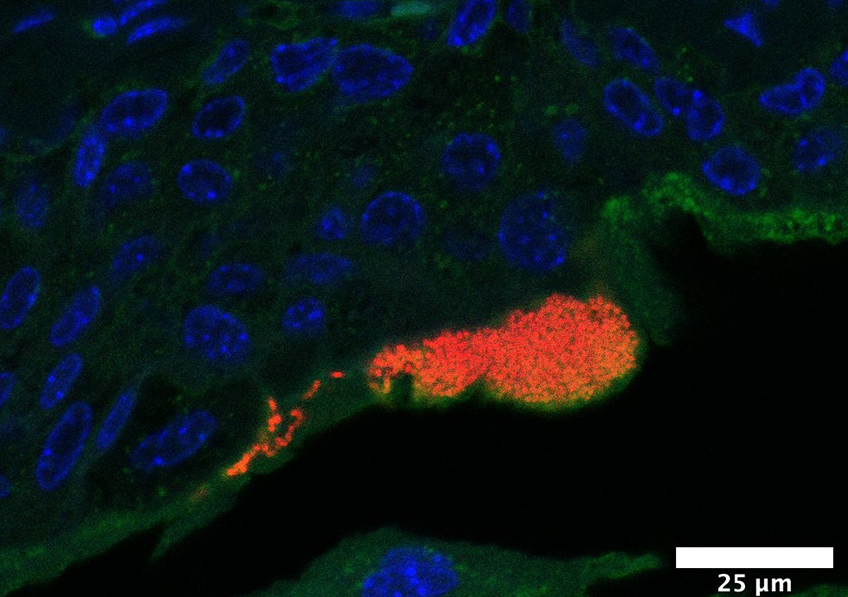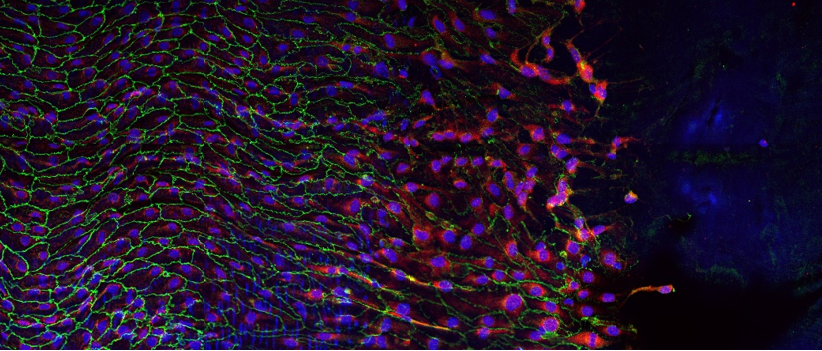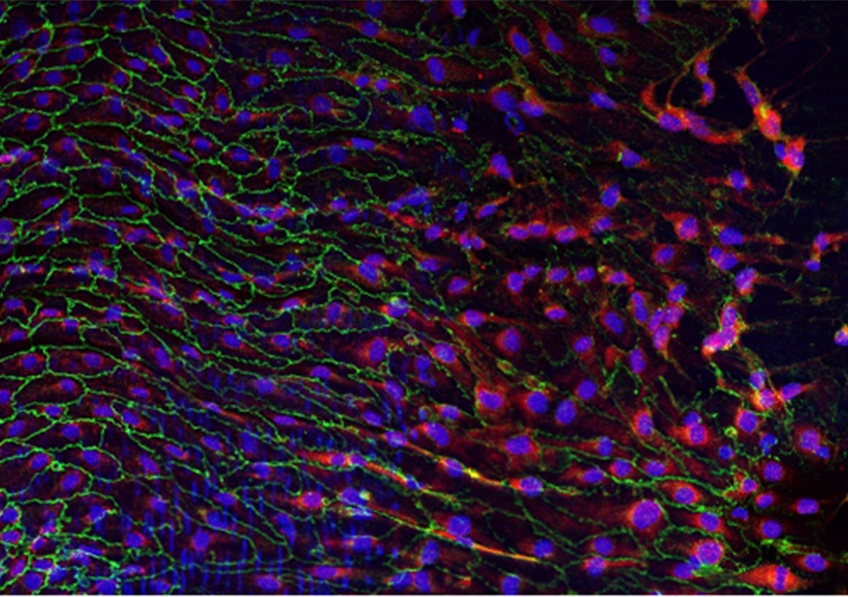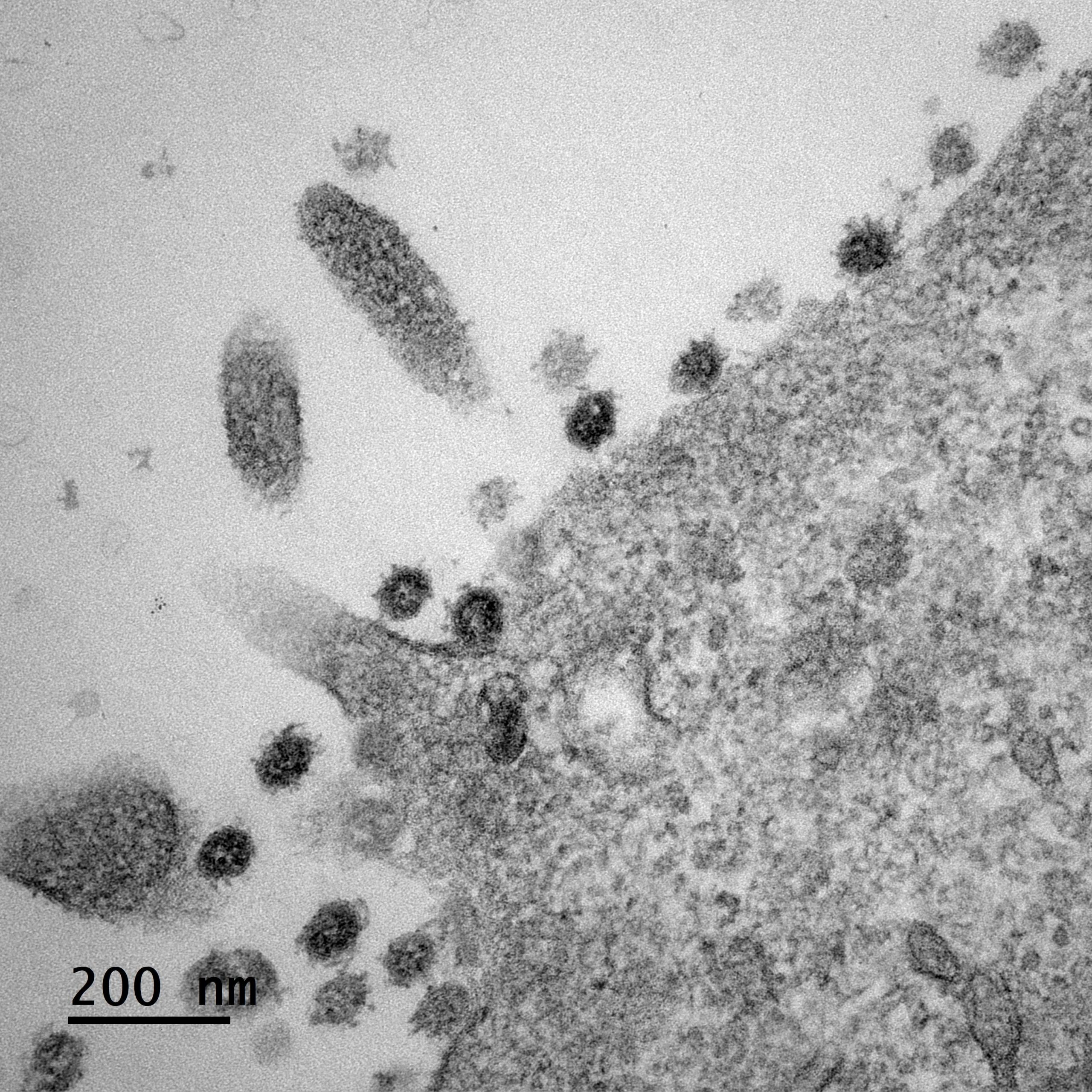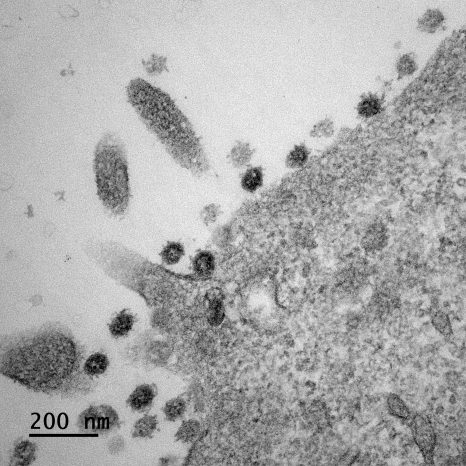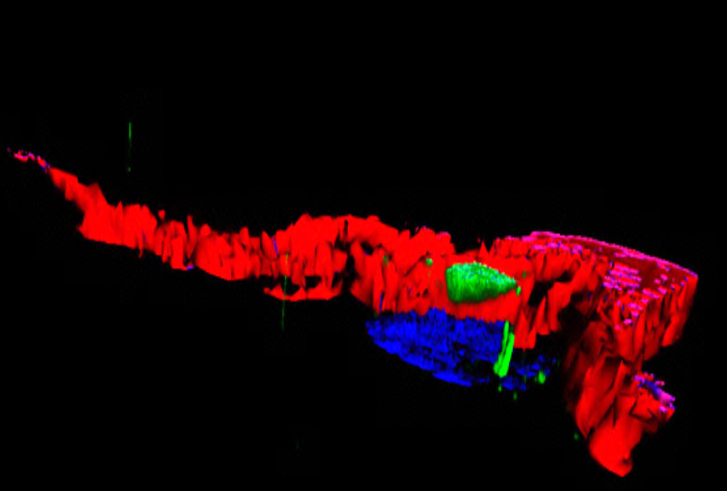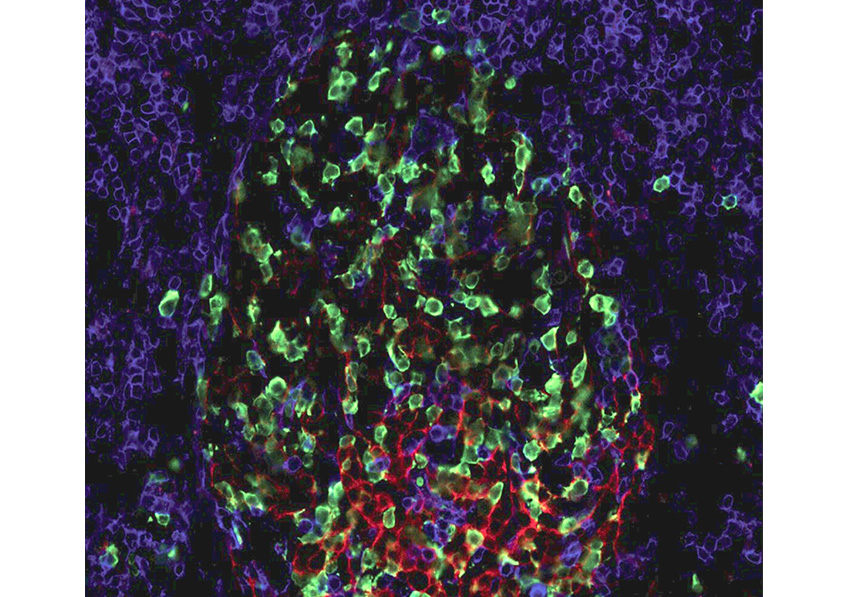
Image d’un centre germinatif persistant (rate de souris, 4 mois après immunisation), comportant des lymphocytes B ou cellules B à mémoire (vert), en forte interaction avec des cellules folliculaires dendritiques (CD35, rouge), et des cellules T helper folliculaires (CD4, bleu). ©Inserm/Reynaud, Claude-Agnès
Des équipes du Pr Matthieu Mahévas du centre de référence des cytopénies auto-immunes de l’adulte et de l’Institut Mondor de Recherche Biomédicale (hôpital Henri-Mondor AP-HP/Inserm/Université Paris-Est Créteil), du Pr Jean-Claude Weill et du Dr Claude-Agnès Reynaud au sein de l’Institut Necker-Enfants Malades (Inserm/CNRS/Université de Paris) ont étudié la présence de lymphocytes B mémoires auto réactifs avant et après traitement par rituximab de patients adultes atteints de thrombopénie immunologique (PTI), une maladie auto-immune rare.
Les résultats de cette étude, qui fait l’objet d’une publication dans la revue Science Translational Medicine le 14 avril 2021, montrent notamment qu’une fraction des lymphocytes B mémoires auto-réactifs envers les antigènes plaquettaires résiste au traitement par rituximab, persiste dans la rate pendant plusieurs mois et participe aux rechutes. La découverte de ces cellules pourrait ouvrir de nouvelles pistes thérapeutiques.
Les patients atteints de maladies auto-immunes médiées par les cellules B, telles que la thrombopénie immunologique (PTI), peuvent bénéficier d’un traitement par l’anticorps anti-CD20, ciblant les cellules B, le rituximab. Une proportion importante de patients rechute cependant après ce traitement.
Les équipes du Pr Matthieu Mahévas du service de médecine interne de l’hôpital Henri-Mondor AP-HP (Pr Godeau et Pr Michel), de l’unité de recherche « Transfusion et maladies du globule rouge » de l’Institut Mondor de Recherche Biomédicale (UPEC/Inserm), du Pr Jean-Claude Weill et du Dr Claude-Agnès Reynaud de l’Institut Necker-Enfants Malades (Inserm/CNRS/Université de Paris), en collaboration avec de nombreux cliniciens du Centre National des cytopénies auto-immunes de l’adulte (CERECAI), ont cherché à comprendre pourquoi en étudiant la présence de lymphocytes B mémoires réactifs envers les plaquettes dans la rate de patients splénectomisés pour une rechute de thrombopénie immunologique après un traitement par rituximab.
Plusieurs approches expérimentales innovantes ont été menées par les Dr Crickx et Chappert afin de déterminer le phénotype, le programme transcriptionnel et la spécificité de ces cellules B capables de secréter des anticorps anti-plaquettes dans la rate des patients lors des rechutes. Ces travaux ont permis de mettre en évidence que des cellules nouvellement générées après reconstitution lymphocytaire B et des cellules mémoires ayant résisté au traitement participaient aux rechutes.
Il apparait ainsi que ces cellules pathogéniques, résistantes au rituximab, ont perdu l’expression du CD20 à leur surface mais conservées l’expression du CD19, spécifiquement exprimée par les lymphocytes B, qui pourrait donc constituer une nouvelle cible thérapeutique potentielle dans cette maladie.
La persistance de la mémoire immunitaire est généralement étudiée pour le bénéfice qu’elle apporte en termes de protection anti-infectieuse. Ce travail démontre que des cellules mémoires peuvent également persister durant des périodes de rémission d’une maladie auto-immune et contribuer aux rechutes ultérieures, suggérant de nouvelles voies à explorer pour favoriser des rémissions prolongées au cours des maladies auto-immunes.