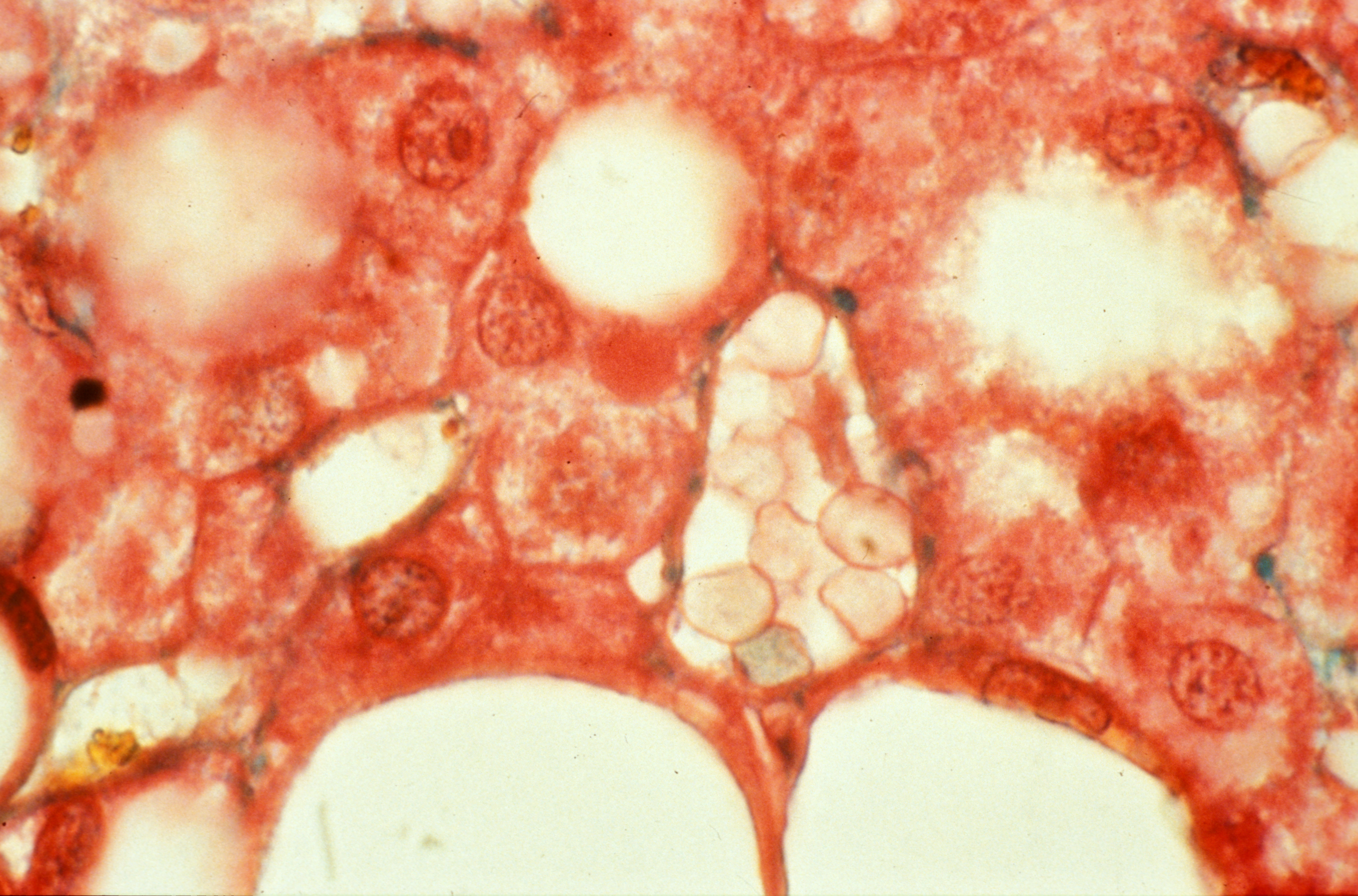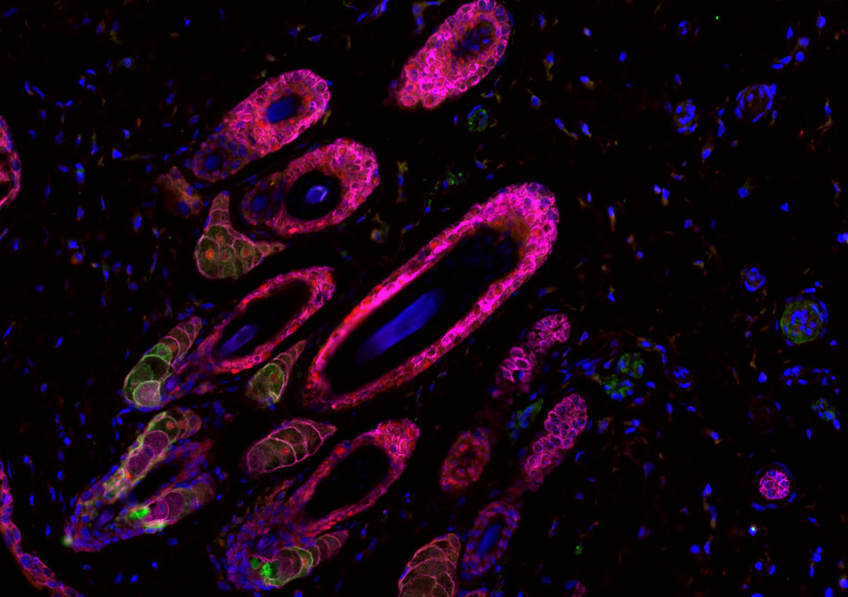
© Institut Pasteur / Pascal Marseaud
Des produits dérivés du microbiote intestinal se retrouvent dans la circulation sanguine et modulent les processus physiologiques de l’hôte, tels que l’immunité, le métabolisme et les fonctions cérébrales. Des scientifiques de l’Institut Pasteur (organisme de recherche partenaire d’Université Paris Cité), de l’Inserm et du CNRS ont découvert dans un modèle animal que des neurones de l’hypothalamus détectent directement les variations de l’activité bactérienne et adaptent l’appétit et la température corporelle en conséquence. Ces résultats montrent l’existence d’un dialogue direct entre le microbiote intestinal et le cerveau, une découverte qui pourrait être exploitée pour de nouvelles approches thérapeutiques contre les troubles métaboliques, tels que le diabète ou l’obésité. Ces résultats seront publiés dans Science le 15 avril 2022.
Le microbiote intestinal constitue le plus grand réservoir de bactéries de l’organisme. De plus en plus de travaux montrent combien l’hôte et son microbiote intestinal sont dépendants l’un de l’autre, et soulignent l’importance de l’axe intestin-cerveau.
A l’Institut Pasteur, des neurobiologistes de l’unité Perception et mémoire (Institut Pasteur/CNRS)[1], des immunobiologistes de l’unité Microenvironnement et immunité (Institut Pasteur/Inserm), et des microbiologistes de l’unité Biologie et génétique de la paroi bactérienne (Institut Pasteur/CNRS/Inserm)[2] ont mis en commun leurs expertises pour comprendre comment les bactéries de l’intestin peuvent avoir un effet direct sur l’activité de certains neurones du cerveau.
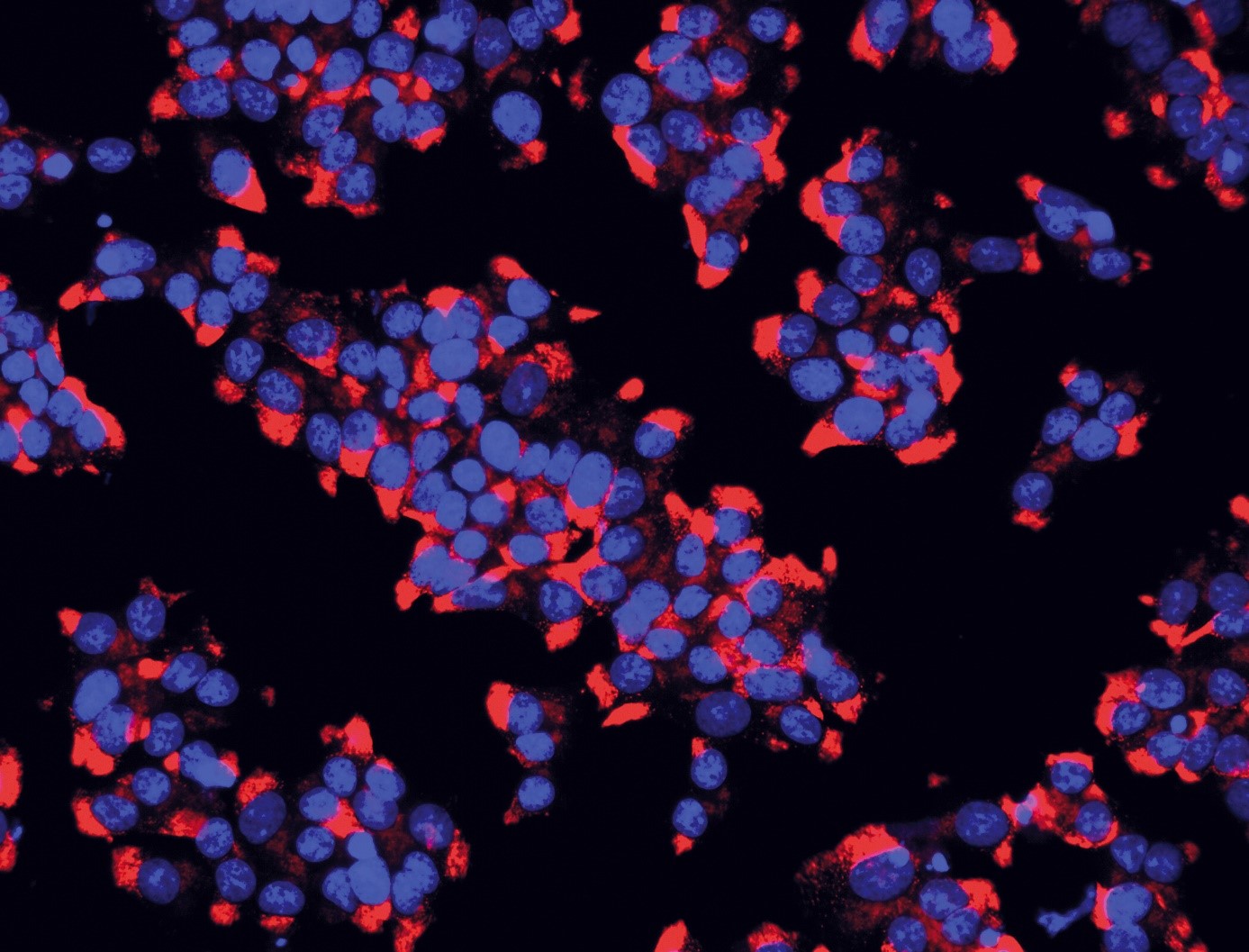
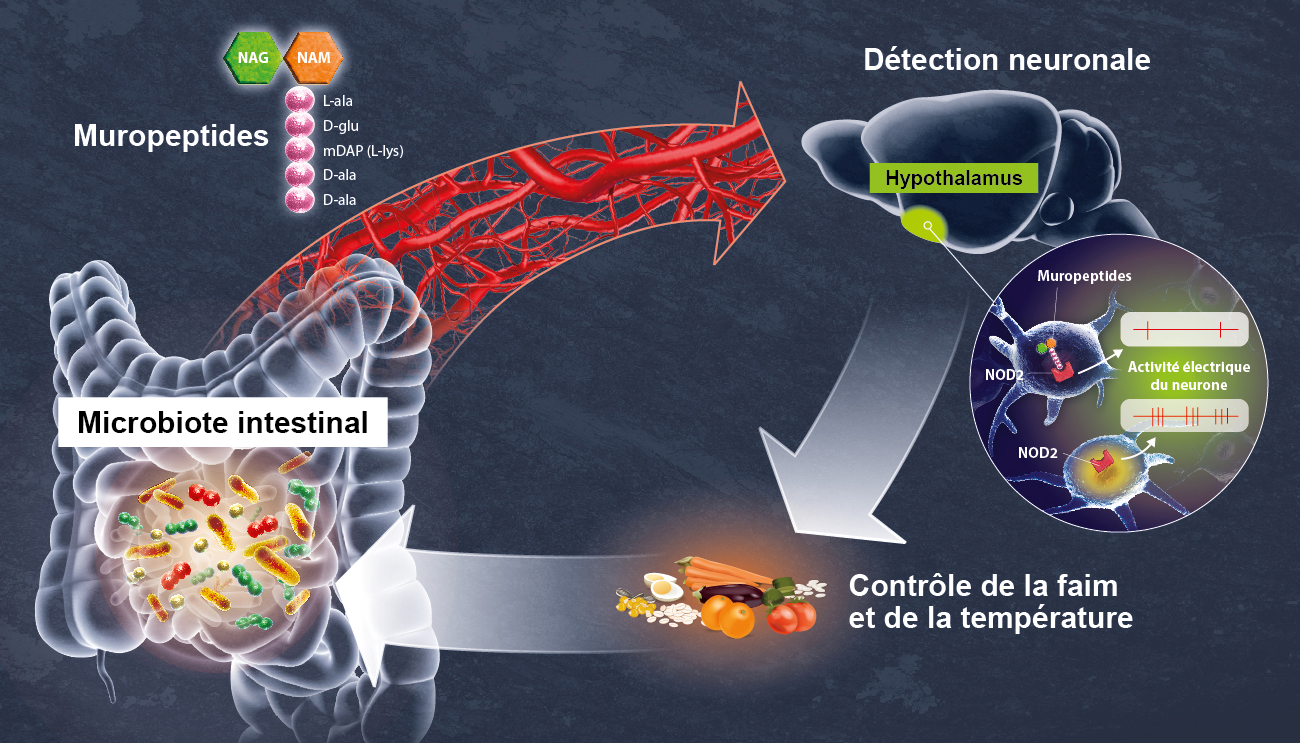
Les scientifiques se sont intéressés particulièrement au récepteur NOD2 (Nucleotide Oligomerization Domain) qui est présent à l’intérieur des cellules, en particulier des cellules immunitaires. Ce récepteur détecte la présence de muropeptides, des composés des parois bactériennes, qui peuvent être considérés comme les produits dérivés du microbiote intestinal.
Par ailleurs, il était déjà connu que des variants du gène codant pour le récepteur NOD2 sont associés à certaines maladies du système digestif, telles que la maladie de Crohn, mais aussi à certaines maladies neurologiques ou troubles de l’humeur.
Ces données ne permettaient pas encore de conclure à un rapport direct entre le fonctionnement des neurones du cerveau et l’activité bactérienne de l’intestin. C’est ce qu’a mis en lumière dans cette nouvelle étude le consortium de scientifiques.
Grâce à des techniques d’imagerie cérébrale, les scientifiques ont tout d’abord observé, chez la souris, que le récepteur NOD2 est exprimé par des neurones de différentes régions du cerveau, et en particulier dans un centre nommé l’hypothalamus. Ils ont ensuite découvert que ces mêmes neurones voient leur activité électrique réprimée lorsqu’ils rencontrent des muropeptides bactériens issus de l’intestin. Les muropeptides sont libérés par les bactéries lorsqu’elles prolifèrent. « Les muropeptides présents dans l’intestin, le sang et le cerveau sont considérés comme les marqueurs de la prolifération bactérienne », explique Ivo G. Boneca, responsable de l’unité Biologie et génétique de la paroi bactérienne à l’Institut Pasteur (CNRS/Inserm).
À l’inverse, dans le cas où le récepteur NOD2 est défaillant, ces neurones ne sont plus réprimés par les muropeptides ; le cerveau perd alors le contrôle de la prise alimentaire et de la température corporelle.
En conséquence, les souris prennent du poids et sont plus susceptibles à développer un diabète de type 2, en particulier chez les femelles âgées.
Chose étonnante, les scientifiques ont montré ici que ce sont les neurones qui perçoivent directement les muropeptides bactériens, alors que cette tâche est généralement dévolue aux cellules du système immunitaire. « Il est stupéfiant de découvrir que des fragments bactériens agissent directement sur un centre nerveux aussi stratégique que l’hypothalamus, connu pour gérer des fonctions vitales comme la température corporelle, la reproduction, la faim, ou la soif » commente Pierre-Marie Lledo, chercheur CNRS et responsable de l’unité Perception et mémoire à l’Institut Pasteur.
Ainsi, les neurones semblent détecter l’activité bactérienne (la prolifération et la mort) pour mesurer directement l’impact de la prise alimentaire sur l’écosystème intestinal. « Il est possible qu’une prise alimentaire excessive ou un aliment particulier favorise l’expansion exagérée de certaines bactéries ou de pathogènes, et mette ainsi en danger l’équilibre intestinal », souligne Gérard Eberl, responsable de l’unité Microenvironnement et immunité à l’Institut Pasteur (Inserm).
Étant donné l’impact des muropeptides sur les neurones de l’hypothalamus et le métabolisme, on peut s’interroger sur leur rôle dans d’autres fonctions du cerveau, et ainsi comprendre l’association entre certaines maladies du cerveau et les variants génétiques de NOD2. Cette découverte ouvre la voie à de nouveaux projets interdisciplinaires pour les trois équipes de recherche et à terme, à de nouvelles approches thérapeutiques contre les maladies du cerveau, ou les maladies métaboliques comme le diabète et l’obésité.
[1] Unité de recherche portant aussi le nom de « Gènes, synapses et cognition » (Institut Pasteur/CNRS).
A également participé à ces résultats, l’Institut du cerveau et de la moelle épinière (CNRS/Inserm/Sorbonne Université/AP-HP).
[2] Autre nom de l’unité CNRS : « Microbiologie intégrative et moléculaire », autre nom de l’unité Inserm : « Interactions hôte-microbes et pathophysiologie » (Institut Pasteur/CNRS/Inserm).