Le projet européen METACARDIS (Metagenomics in Cardiometabolic Diseases), coordonné par l’Inserm, vise à étudier le rôle de la flore intestinale dans le développement des maladies cardio-métaboliques. Grâce au soutien de la Commission Européenne, quatorze partenaires de six pays européens s’engagent sur 5 ans à traduire les résultats obtenus en nouvelles méthodes de diagnostic et de traitement de ces pathologies, dans un esprit de médecine personnalisée. Ce projet implique également des chercheurs et cliniciens de l’Institut Hospitalo-Universitaire ICAN.
Le projet METACARDIS a pour but le développement et la mise en place de traitements personnalisés des patients atteints de maladies cardio-métaboliques pour répondre à l’urgence d’une meilleure prise en charge, et diminuer le fardeau socio-économique pour le système de santé. En effet, les maladies cardio-métaboliques – qui regroupent les maladies cardiovasculaires, les maladies métaboliques et l’obésité – représentent une cause majeure de mortalité et de morbidité dans le monde. Elles sont associées à un coût socio-économique considérable, puisqu’on estime les seuls coûts des maladies cardiovasculaires à plus de 192 milliards d’euros par an pour l’économie européenne (57% dus aux traitements directs, 21% à la perte de productivité et 22% dus à la prise en charge indirecte[1]).
L’objectif de METACARDIS est d’étudier l’impact des changements de la flore intestinale sur l’apparition et la progression des maladies cardio-métaboliques et des pathologies associées. Ces pathologies se manifestent de façon très hétérogène et sont vraisemblablement reliées les unes aux autres par des voies et des dysfonctions initiales communes. Ce constat rend indispensable une connaissance accrue des mécanismes physiopathologiques, la mise en place d’un diagnostic précoce et fin, ainsi que de traitements adaptés à chaque pathologie. C’est-à-dire :
- Trouver des nouvelles cibles et voies biologiques partagées jouant un rôle dans la progression des maladies cardio-métaboliques.
- Valider les cibles et bio-marqueurs venant de la flore intestinale.
- Affiner l’analyse des profils cliniques des patients par un phénotypage moléculaire.
- Développer de nouveaux systèmes (logiciels) pour l’intégration des données venant de l’environnement et des informations cliniques et biologiques des patients.
METACARDIS représente la première étude systémique pour corréler la flore intestinale et les maladies cardio-métaboliques chez l’homme.
Le projet allie des groupes de chercheurs européens multidisciplinaires et des experts du secteur de la biotechnologie et de l’industrie, qui auront accès à des technologies de pointe pour faire progresser le développement de nouvelles stratégies préventives et thérapeutiques des maladies cardio-métaboliques. Parmi ces équipes, celles de Karine Clément et Dominique Gauguier de l’unité Inserm 872 « Centre de recherche des Cordeliers » et de l’Institut Hospitalo-Universitaire ICAN, de Serge Hercberg de l’unité Inserm 557 « Epidémiologie nutritionnelle », d’Hervé Blottière, de Joel Dore et de Dusko Ehrlich de l’INRA.Les études préliminaires sur lesquelles s’appuie le projet METACARDIS
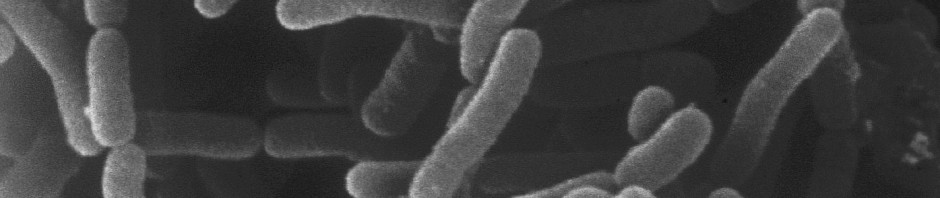
Ces dernières années, la caractérisation génomique de la flore intestinale, c’est-à-dire l’ensemble du génome bactérien de l’intestin, a ouvert de nouvelles perspectives dans la connaissance fondamentale de possibles voies partagées entre les différentes pathologies que composent les maladies cardio-métaboliques.
Dans le domaine de l’oncologie, des signatures biologiques ont été identifiées comme permettant de prédire les caractéristiques des tumeurs. De même, des travaux ont montré que des modèles d’expression des gènes de la flore intestinale varient dans les différentes affections cardio-métaboliques. Des patients obèses présentant une résistance à l’insuline, un syndrome inflammatoire, une dyslipidémie et/ou et une dérégulation du glucose sont caractérisés par une altération de la diversité et de la composition de la flore microbienne intestinale. Certaines espèces bactériennes de la flore intestinale ont même été trouvées associées à des pathologies vasculaires et coronariennes. Ainsi, des déséquilibres de la flore digestive pourraient contribuer au développement d’affections cardio-métaboliques.
Les patients impliqués dès la fin de l’année 2012
Dés le début du projet – fin 2012 – METACARDIS conduira les premières études sur une cohorte de patients déjà existante (projets MetaHIT et Micro-Obes ; > 200 sujets), laquelle donnera un accès immédiat à de nombreuses données cliniques, médicales et environnementales ainsi qu’à des échantillons biologiques. Ceci permettra d’entreprendre une première recherche sur des biomarqueurs des maladies cardio-métaboliques par approche métabolomique et profilage métagénomique. Une deuxième cohorte de patients avec des maladies cardio-métaboliques à différents stades sera mise en place au cours du projet dans 3 pays (France, Danemark, Allemagne) (fin du recrutement prévu mi-2015). Plus de 2000 patients dont près de la moitié, sera collectée dans le pôle cœur et métabolisme de l’Hôpital Pitié-Salpêtrière.
Des informations sur le style de vie (nutrition, activité physique et des facteurs psychosociaux) seront intégrées aux données cliniques et biologiques des patients pour évaluer leur influence sur la flore intestinale et la progression des maladies associées. Ces données seront combinées avec des études interventionnelles reconnues pour diminuer les risques des maladies cardio-métaboliques.
Pour en savoir plus
Inserm, France
INRA, France
Imperial College London, Royaume-Uni
University of Copenhagen, Danemark
European Molecular Biology Laboratory, Allemagne
University of Göteborg, Suède
Flemish Institute for Biotechnology, Belgique
Assistance Publique – Hôpitaux de Paris, France
University of Leipzig, Allemagne
Danone Research, France
Cargill, France
Chalmers University of Technology, Suède
Inserm Transfert, France
Biobyte Solutions, Allemagne
[1] Leal J. et al, 2012, Economic Costs In: European Cardiovascular Disease Statistics