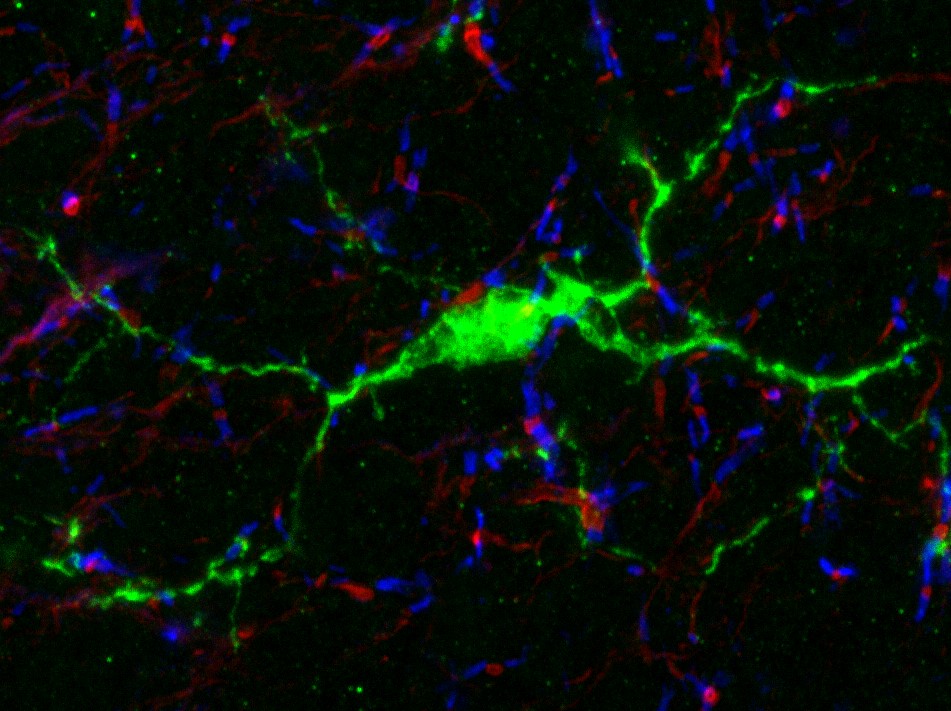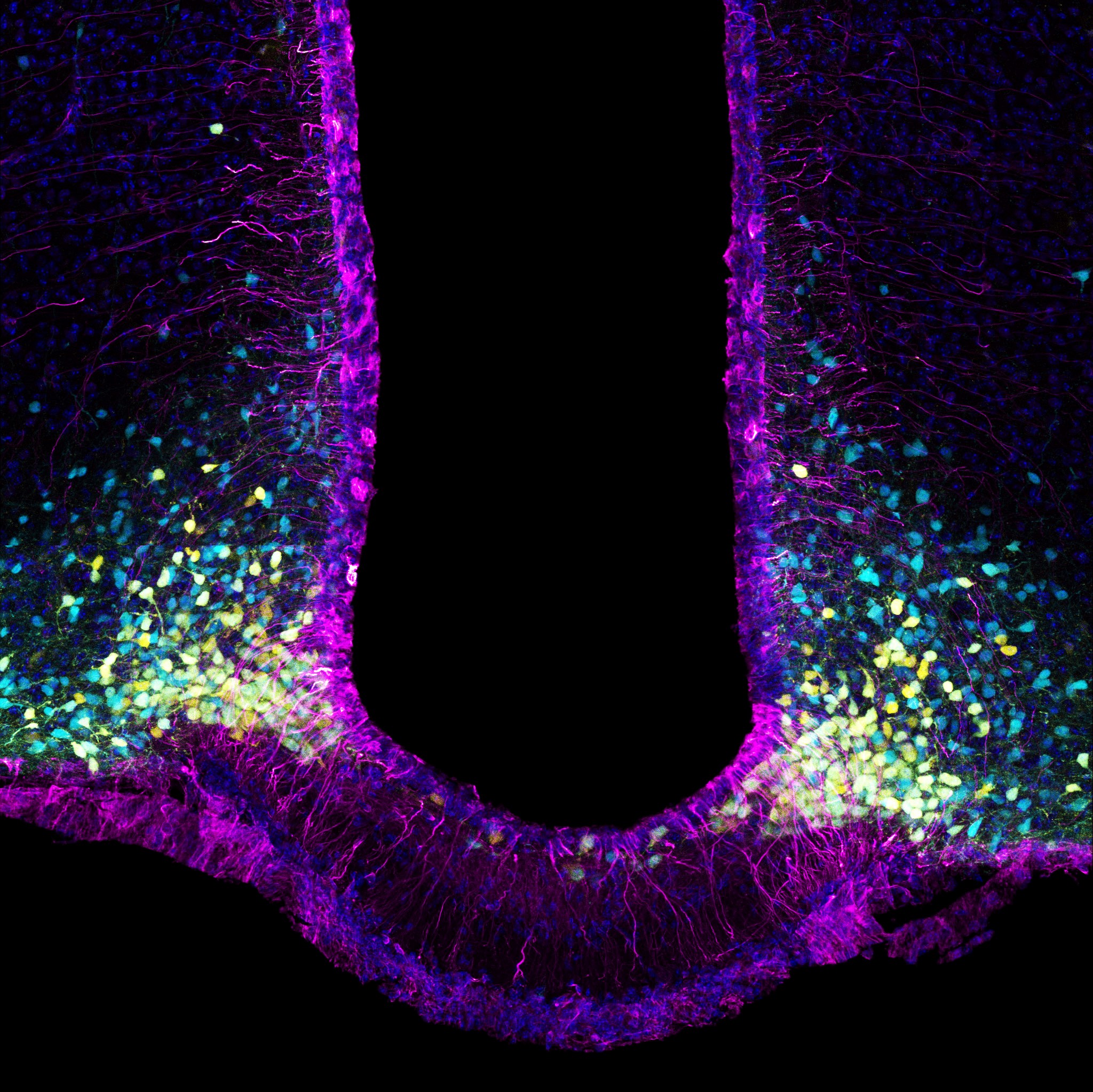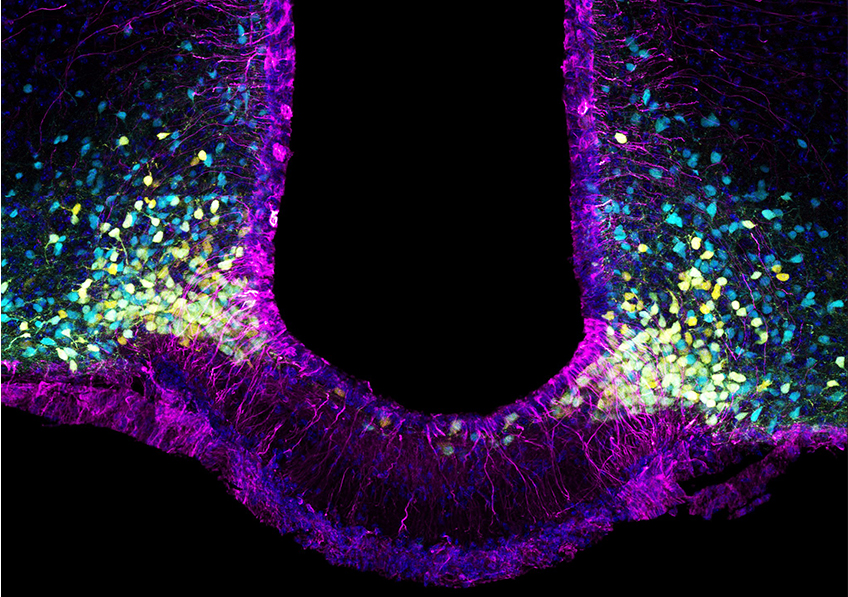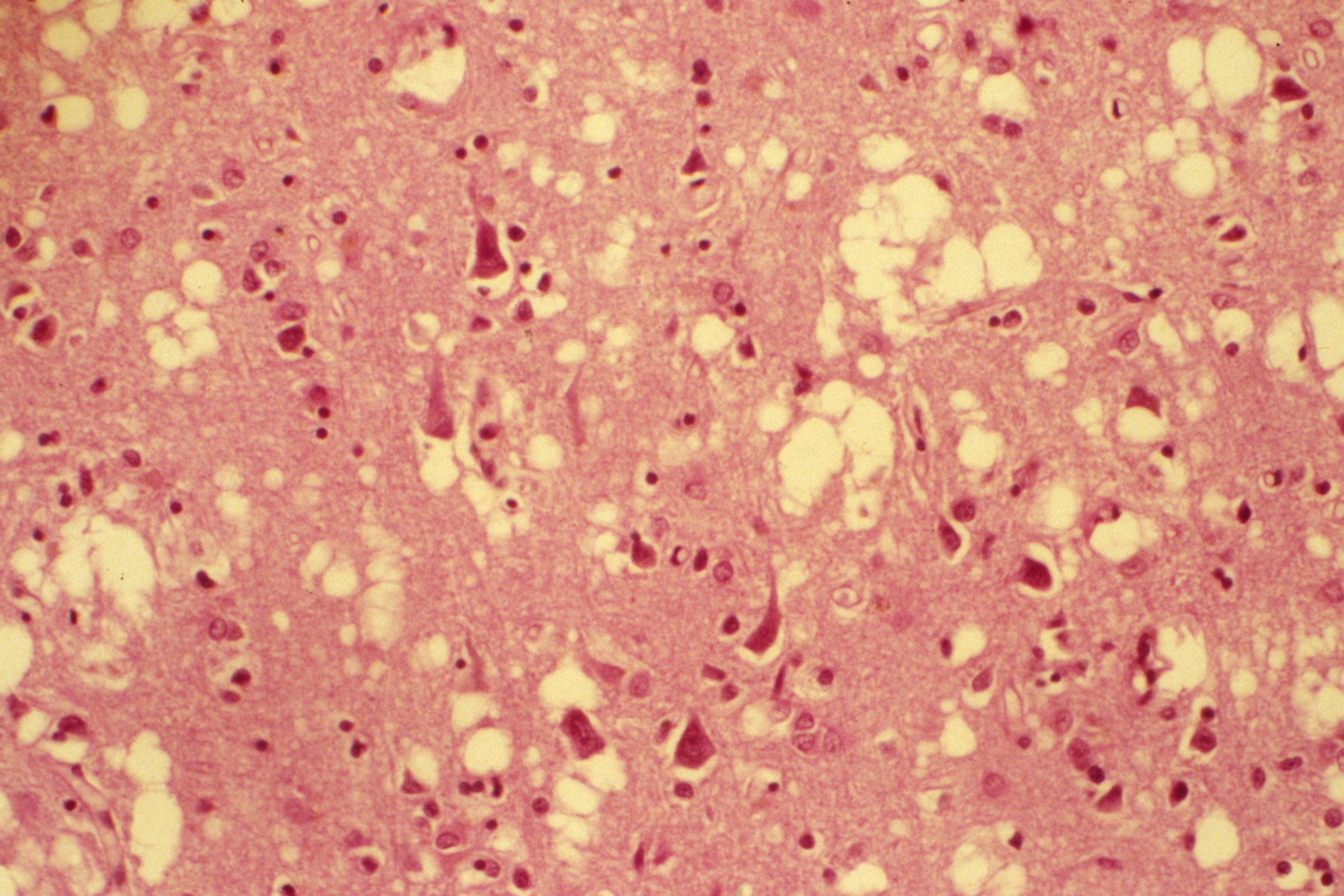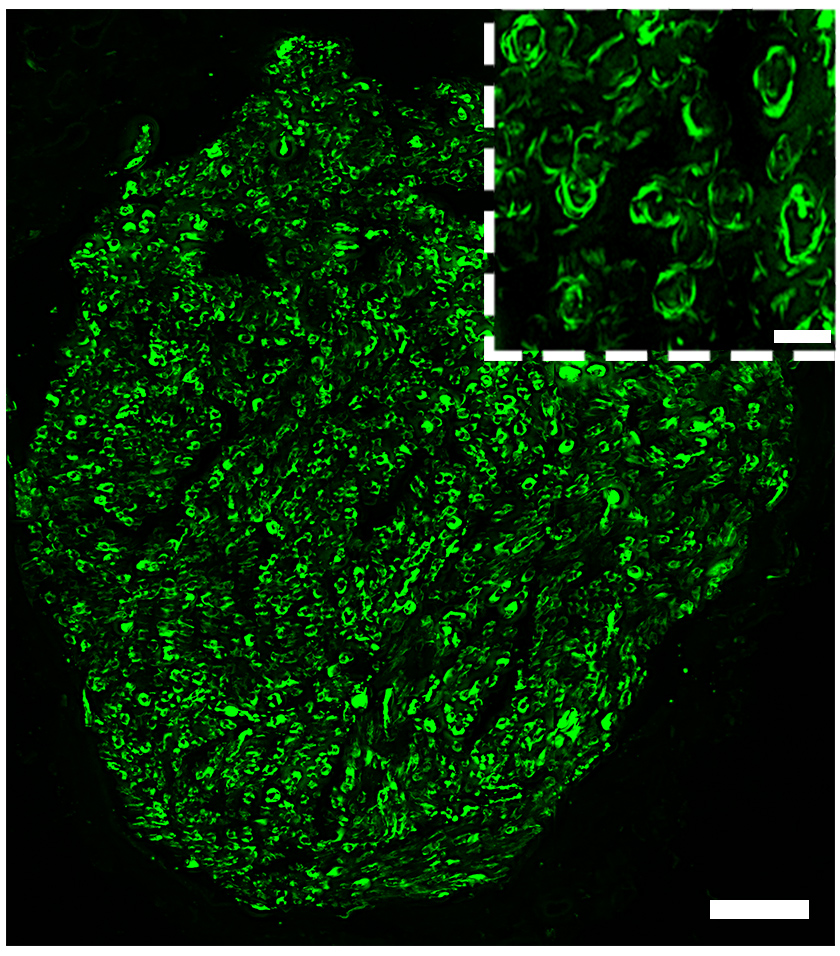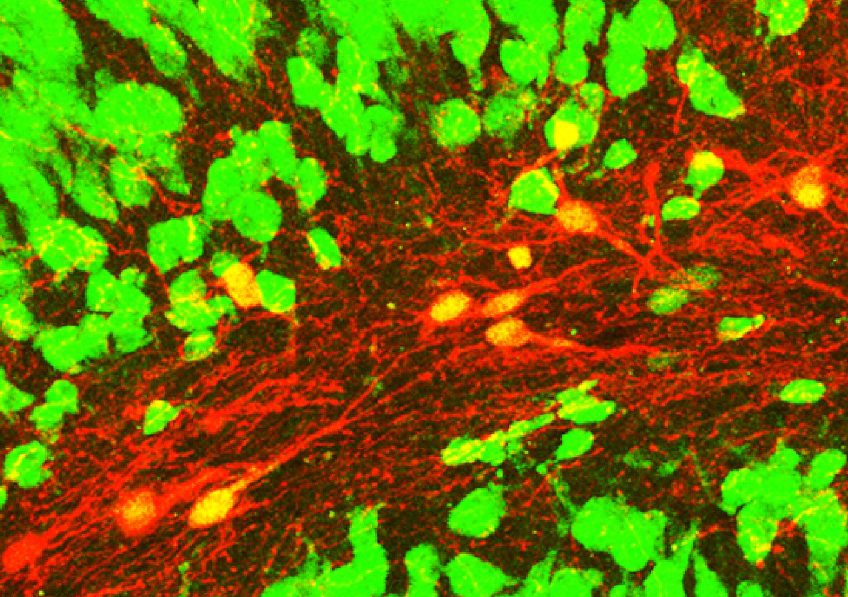
Image de microscopie confocale montrant des neurones induits (rouges avec un noyau jaune) exprimant le marqueur neuronal NeuN (vert) au sein d’un hippocampe de souris épileptique. © Extrait de: Lentini et al., Cell Stem Cell, 2021.
De nombreuses pathologies du système nerveux central sont associées à une mort de neurones sans que le cerveau ne soit capable de les régénérer. Ce phénomène est notamment observé dans la maladie de Parkinson ou d’Alzheimer, suite aux accidents vasculaires cérébraux mais aussi dans certaines formes d’épilepsies. Comment régénérer ces neurones perdus ? C’est à cette question qu’a répondu une équipe de chercheurs de l’Inserm, du CNRS et de l’Université Claude Bernard Lyon 1 à l’Institut Cellule Souche et Cerveau, en collaboration avec le King’s College de Londres. En utilisant un modèle animal d’épilepsie, les chercheurs et chercheuses sont parvenus à transformer des cellules non-neuronales présentes dans le cerveau en nouveaux neurones inhibiteurs qui permettent de diminuer de moitié l’activité épileptique chronique. Ces travaux permettent d’envisager à terme un effet thérapeutique de cette stratégie. Les résultats de cette étude font l’objet d’une publication dans la revue Cell Stem Cell
Notre cerveau est globalement dépourvu de capacités régénératives pour remplacer les neurones endommagés ou perdus. L’objectif de la médecine régénérative est de remplacer les cellules perdues afin de corriger les troubles fonctionnels associés à la perte de ces cellules. La reprogrammation cellulaire directe (par opposition à la reprogrammation en cellules souches pluripotentes induites) a émergé comme une stratégie innovante qui consiste à « reprogrammer » l’identité de certaines cellules non-neuronales présentes au sein même du cerveau malade pour les transformer en neurones. Pour que cette stratégie puisse être efficace, les défis sont nombreux. Les nouveaux neurones doivent s’intégrer dans les réseaux de neurones survivants et prendre le relai des neurones qu’ils remplacent afin de corriger les troubles pathologiques.
C’est cette stratégie qui est explorée dans une nouvelle étude publiée dans la revue Cell Stem Cell. Une équipe de chercheurs associant l’Inserm, le CNRS et de l’Université Claude Bernard Lyon 1 est ainsi parvenue à transformer des cellules gliales du cerveau en nouveaux neurones dans un modèle de souris atteint d’épilepsie mésio-temporale, la forme d’épilepsie pharmaco-résistante la plus fréquente chez l’Homme.
Les cellules gliales en prolifération : une source cellulaire pour générer des neurones
Lors de la mort neuronale, comme observée dans le cas de l’épilepsie mésio-temporale, la forme la plus fréquente d’épilepsie focale de l’adulte, les cellules gliales présentes dans l’environnement direct des neurones endommagés réagissent en se multipliant sans que cette réponse gliale ne résolve le problème.
Dans le cadre de l’étude, les chercheurs ont eu l’idée de tirer parti de cette prolifération et d’utiliser ces cellules gliales surnuméraires. Dans un premier temps, il a fallu identifier des gènes permettant de transformer ces cellules gliales en neurones inhibiteurs, dont la perte joue un rôle clé dans la survenue des crises épileptiques, afin de rétablir l’équilibre des activités neuronales qui a été impacté. Les chercheurs ont ainsi sélectionné des gènes connus pour être impliqués dans la genèse de ces neurones inhibiteurs durant le développement.
En forçant l’expression de ces gènes, ils ont pu reprogrammer l’identité des cellules gliales pour en faire des neurones dits « neurones induits », dont les propriétés sont comparables à ceux disparus dans la maladie. Grâce à une chirurgie stéréotaxique[1], les gènes ont été insérés directement dans le cerveau des souris au niveau du foyer épileptique à l’aide de vecteurs viraux désactivés induisant la reprogrammation des cellules gliales. En quelques semaines, la grande majorité de ces cellules gliales ayant reçu les gènes s’étaient transformées en nouveaux neurones.
Des neurones fonctionnels intégrés dans le réseau épileptique
Les résultats de l’étude indiquent que les neurones induits adoptent une identité de neurones inhibiteurs qui présentent un ensemble de caractéristiques moléculaires comparables à celles des neurones qui ont dégénéré dans l’épilepsie.
Grâce à des enregistrements électrophysiologiques, les scientifiques ont pu confirmer qu’il s’agissait bien de neurones fonctionnels, capables d’inhiber les neurones voisins responsables des crises, réduisant ainsi leur activité. Puis, grâce à des traçages des connexions entre les neurones, ils ont pu déterminer que les neurones induits étaient pleinement intégrés dans le réseau épileptique mais également plus largement dans le cerveau.
Enfin, grâce à des enregistrements électroencéphalographiques (EEG) réalisés dans le foyer des crises, les chercheurs ont pu montrer chez les souris reprogrammées une réduction de moitié des crises épileptiques.
« Ces résultats révèlent ainsi le potentiel thérapeutique de cette stratégie de reprogrammation cellulaire pour combattre une pathologie comme l’épilepsie mésio-temporale. Une aubaine dans le cas précis de cette maladie alors que 30% des patients qui en sont atteints sont réfractaires aux traitements pharmacologiques », explique Christophe Heinrich, concepteur de l’étude.
Même si la route est encore longue avant d’aboutir à une réelle transposition de ces recherches aux patients, cette étude met en lumière la reprogrammation des cellules gliales en neurones comme une nouvelle stratégie capable de modifier une pathologie telle que l’épilepsie, mais qui pourrait se généraliser à d’autres pathologies dévastatrices de notre cerveau.
[1] Technique utilisée en neurochirurgie pour atteindre des zones du cerveau de manière précise grâce à un système de coordonnées 3D dans l’espace.