L’équipe du service de cardiologie de l’hôpital Bichat et de l’Unité mixte Inserm 698 (AP-HP, Université Paris Diderot), en collaboration avec des équipes internationales a étudié une cohorte de patients atteints de maladie coronaire. Cette étude a mis en évidence chez les patients ayant des antécédents d’accident vasculaire cérébral (AVC) ou d’accident ischémique transitoire (AIT) non seulement un risque plus élevé d’événements cardio-vasculaires mais aussi d’événements hémorragiques, soulignant le défi thérapeutique que représente la prise en charge de ces patients. Les travaux ont fait l’objet d’une publication on-line dans Circulation*.
crédit Serimedis/Inserm
Les maladies cardio et cérébro-vasculaires représentent les deux premières causes de mortalité au monde. Elles sont parfois associées chez un même patient et leur combinaison représente à la fois un risque considérable pour le patient et un défi thérapeutique.
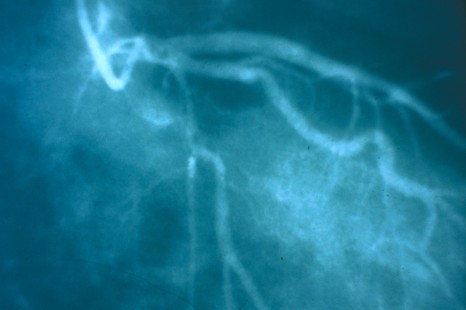
Aujourd’hui, les médicaments antithrombotiques qui permettent de fluidifier le sang sont un traitement efficace de la maladie coronaire. Plusieurs essais randomisés évaluant de nouveaux traitements antithrombotiques chez des patients coronariens ont identifié qu’un antécédent d’AVC ou d’AIT constituait un marqueur d’augmentation du risque d’hémorragie intracrânienne pouvant conduire au décès du patient. L’étude menée par l’équipe du service de Cardiologie de l’hôpital Bichat et de l’Unité Inserm 698 associée à plusieurs équipes internationales a consisté à suivre et à analyser pendant 4 ans, 26 389 patients coronariens issus du registre international de patients athérothrombotiques REACH afin de caractériser de manière très précise le risque ischémique et hémorragique associé à un antécédent d’AVC ou d’AIT chez les patients coronariens.
Les résultats de cette étude mettent en évidence la fréquence de ce phénomène, 4 460 patients, soit 17% de la cohorte de patients coronariens, avaient un antécédent d’AVC ou d’AIT. Cet antécédent d’AVC ou d’AIT était de plus associé à une augmentation d’environ 50% (par rapport aux patients coronariens sans antécédent d’AVC) du risque de décès, d’infarctus, ou d’AVC, avec une augmentation du risque d’AVC ischémique et hémorragique.
Cette étude objective également le défi thérapeutique que représente le traitement de ces patients. En effet, un traitement antiplaquettaire ou anticoagulant plus fortement dosé est associé à une augmentation particulièrement élevée du risque hémorragique.
« Les conclusions de l’étude sont importantes puisqu’elles soulignent la difficulté de prise en charge de ce type de patients, fréquents et dont le pronostic est particulièrement grave. Elles démontrent par ailleurs la nécessaire sélection du traitement antithrombotique. Des essais cliniques complémentaires sont en cours pour tester de nouvelles stratégies de traitement chez ces patients » explique le Pr Steg, du service de cardiologie de l’hôpital Bichat.
L’accident vasculaire cérébral (AVC) désigne l’obstruction ou la rupture d’un vaisseau transportant le sang dans le cerveau. Il en résulte un manque d’apport d’oxygène mettant en danger le fonctionnement d’une ou plusieurs zones du cerveau.
Un accident vasculaire cérébral (AVC) survient lorsque la circulation sanguine vers ou dans le cerveau est interrompue par : un vaisseau sanguin bouché (AVC ischémique), le plus fréquent ou un vaisseau sanguin rompu (AVC hémorragique), dans moins de 20% des cas.
L’AVC ischémique (ou « infarctus cérébral »). L’artère est bouchée par une plaque riche en cholestérol (athérosclérose), on parle de thrombose cérébrale (40 à 50 % des AVC), ou un caillot de sang, venu obstruer l’artère, il s’agit alors d’une embolie cérébrale (30 % des AVC).
L’AVC hémorragique (20 % des cas). Il est dû le plus souvent à une rupture d’anévrisme. Les tumeurs, les crises d’hypertension et divers troubles de la coagulation peuvent eux aussi entraîner des hémorragies cérébrales.
L’Accident Ischémique Transitoire (AIT). Lorsque l’obstruction de l’artère cérébrale se résorbe d’elle-même et ne provoque pas de séquelle, on parle d’accident ischémique transitoire. Ses symptômes sont les mêmes que l’AVC, mais ils durent de quelques secondes à quelques minutes avant le retour à la normale. L’AIT peut donc passer inaperçu et être confondu avec un simple malaise. Il signale pourtant un risque important d’AVC plus grave.