 © Pexels
© Pexels
Le SOPK, ou syndrome des ovaires polykystiques, est l’une des principales causes d’infertilité féminine. Alors qu’il n’existe toujours pas de traitement qui s’attaque aux causes de la maladie, des chercheurs et des chercheuses de l’Inserm, du CHU de Lille et de l’université de Lille ont réussi à empêcher l’apparition de ses principaux symptômes – tels que l’infertilité et les troubles métaboliques entraînant une prise de poids – chez des souris, grâce à des anticorps bloquant l’activité de l’hormone anti-Müllérienne (AMH), impliquée dans le processus de reproduction. Les souris adultes qui présentaient déjà des symptômes ont vu ces derniers reculer. Publiés le 11 avril dans la revue Cell Metabolism, les résultats de cette étude montrent aussi que lors de la « mini-puberté », peu après la naissance, l’exposition à l’hormone AMH augmente le risque de développer le SOPK. Un brevet a été déposé par les scientifiques.
Le SOPK, ou syndrome des ovaires polykystiques, touche environ 10 % des femmes, et est l’une des principales causes d’infertilité féminine[1]. Ce déséquilibre hormonal, caractérisé par la présence de nombreux follicules (un ensemble de petites cellules contenues dans les ovaires) immatures bloqués dans leur développement, entraîne une surproduction d’hormones mâles – notamment de testostérone –, ce qui perturbe le cycle de l’ovulation et affecte la fertilité. De plus, le SOPK est associé à de nombreux risques pour la santé, comme les maladies cardiaques, le surpoids et le diabète[2].
Des traitements existent, mais ils s’attaquent uniquement à certains symptômes de la maladie (hyperpilosité, acné…), et non à ses causes, encore mal connues. Une équipe de recherche dirigée par Paolo Giacobini, directeur de recherche Inserm au sein du Centre de recherche Lille Neurosciences et cognition (Inserm/CHU de Lille/Université de Lille) esquisse toutefois une nouvelle piste thérapeutique.
Au cours de leurs expériences, les chercheurs sont parvenus à prévenir l’apparition de symptômes comparables à ceux du SOPK (infertilité, troubles métaboliques entraînant par exemple une prise de poids) chez des souris, en bloquant peu après leur naissance l’activité de l’hormone anti-Müllérienne (AMH), produite en excès par les follicules ovariens dans le cadre du syndrome. Administré à des souris adultes présentant déjà ces symptômes, le blocage de l’activité de l’AMH a permis de les faire reculer de manière significative.
L’équipe a d’abord voulu comprendre si des doses importantes d’hormone AMH lors de ce qu’on appelle la « mini-puberté » augmentaient le risque de développer le SOPK.
« La mini-puberté est une phase transitoire clé dans la croissance de tous les mammifères (y compris l’être humain). Elle survient dans les premiers jours ou les mois suivant la naissance, selon les espèces. Pendant cette période, on observe une stimulation des neurones qui produisent une hormone, appelée GnRH (pour Gonadotropin Releasing Hormone), et qui sont chargés de réguler les fonctions de reproduction. Cela entraîne une augmentation de la production d’hormones sexuelles telles que la testostérone chez les mâles et les œstrogènes chez les femelles. Cette poussée hormonale précoce prépare le corps à la fonction de reproduction future », explique Paolo Giacobini, directeur de recherche à l’Inserm et dernier auteur de l’étude.
Pour tester cette idée, les chercheurs ont administré trois injections d’AMH à un premier groupe de souris, entre le deuxième et le quatorzième jour suivant leur naissance. Alors que de précédentes recherches ont déjà montré qu’une exposition du fœtus à des taux élevés d’AMH pendant la grossesse augmente le risque de développer des symptômes du SOPK plus tard dans la vie, « l’étude révèle que la mini-puberté est également une période à risque, puisque les souris ayant reçu des injections importantes d’AMH durant cette phase ont développé à l’âge adulte des symptômes du SOPK, comme l’infertilité et le troubles métaboliques provoquant par exemple une prise de poids », poursuit Paolo Giacobini.
Les chercheurs ont alors émis une hypothèse : et si bloquer l’activité de cette hormone AMH permettait de prévenir, voire traiter les symptômes du SOPK ? Pour cela, ils ont développé un nouvel anticorps, nommé Ha13, afin d’obstruer les récepteurs de l’hormone anti-Mullérienne dans les ovaires et situés sur les neurones qui produisent la GnRH et sont chargés de réguler les fonctions de reproduction[3]. Ce traitement a ensuite été administré à deux autres groupes de souris. Les premières ont reçu les anticorps entre 10 et 15 jours après leur naissance, lors de la mini-puberté, les autres, à l’âge adulte, alors qu’elles présentaient déjà des symptômes du SOPK.
Résultat :
« Administrés lors de la mini-puberté, ces bloqueurs d’hormone AMH ont eu un effet préventif : les souris du premier groupe n’ont pas développé les principaux symptômes du SOPK plus tard dans leur vie. Et chez les souris adultes qui en souffraient déjà, les anticorps ont permis de les faire reculer : les cycles, l’ovulation et les taux d’androgènes sont revenus à la normale, ce qui suggère que très probablement que la fertilité est améliorée », raconte Paolo Giacobini.
À l’avenir, l’équipe souhaite reproduire l’expérience auprès de femmes adultes souffrant du SOPK afin de confirmer l’intérêt de cette piste thérapeutique.
« En ce qui concerne les êtres humains, l’administration du traitement lors de la mini-puberté n’est pas possible dans l’immédiat, dans la mesure où le diagnostic du SOPK survient seulement après les premières règles et où des travaux supplémentaires doivent étudier les conséquences à long terme de ce “ blocage” sur l’organisme. En revanche, les anticorps ciblant le récepteur de l’AMH pourraient à l’avenir représenter une piste thérapeutique prometteuse pour le traitement des troubles liés au SOPK, chez les femmes adultes. Étant donné l’impact majeur du SOPK sur la fertilité et sur la qualité de vie, cette étude représente une avancée majeure pour la santé des femmes et la médecine reproductive », conclut Paolo Giacobini.
Un brevet a été déposé par les scientifiques via Inserm Transfert, la filiale privée de l’Inserm, dont la mission principale est de valoriser les innovations issues des laboratoires de recherche de l’établissement.
[1] Syndrome des ovaires polykystiques (SOPK) · Inserm, La science pour la santé
[2] Recommendations From the 2023 International Evidence-based Guideline for the Assessment and Management of Polycystic Ovary Syndrome – PubMed
[3] Des neurones de la reproduction… un peu partout dans le cerveau · Inserm, La science pour la santé




 La voiture, le bus, le métro, le RER et le tram sont les modes de transport où les participants de l’étude ont le plus été exposés à la pollution sonore (image d’illustration). © AdobeStock
La voiture, le bus, le métro, le RER et le tram sont les modes de transport où les participants de l’étude ont le plus été exposés à la pollution sonore (image d’illustration). © AdobeStock




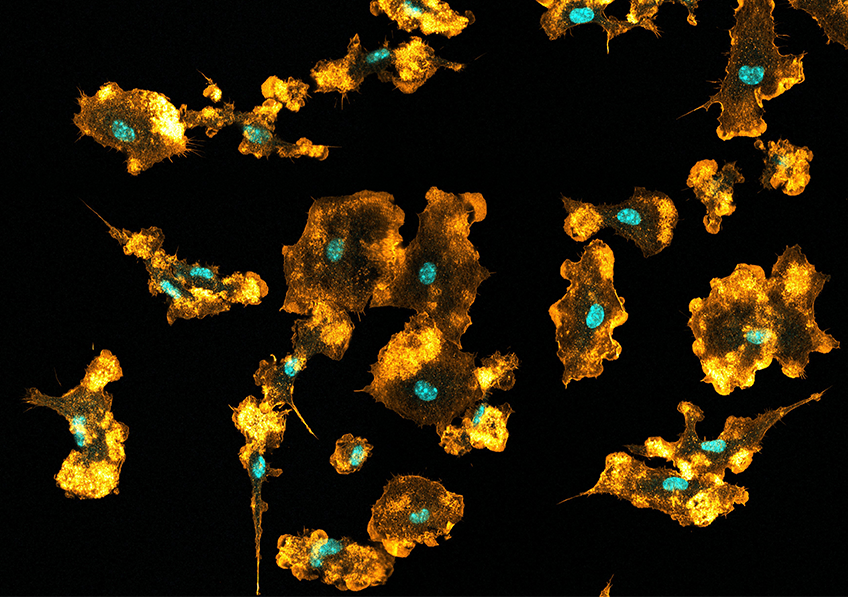 Macrophages de souris visualisés en imagerie par microscopie confocale. Les noyaux sont visibles en bleu, le réseau d’actine en orange. © Mónica Fernández Monreal, Bordeaux Imaging Centre
Macrophages de souris visualisés en imagerie par microscopie confocale. Les noyaux sont visibles en bleu, le réseau d’actine en orange. © Mónica Fernández Monreal, Bordeaux Imaging Centre


 © AdobeStock
© AdobeStock