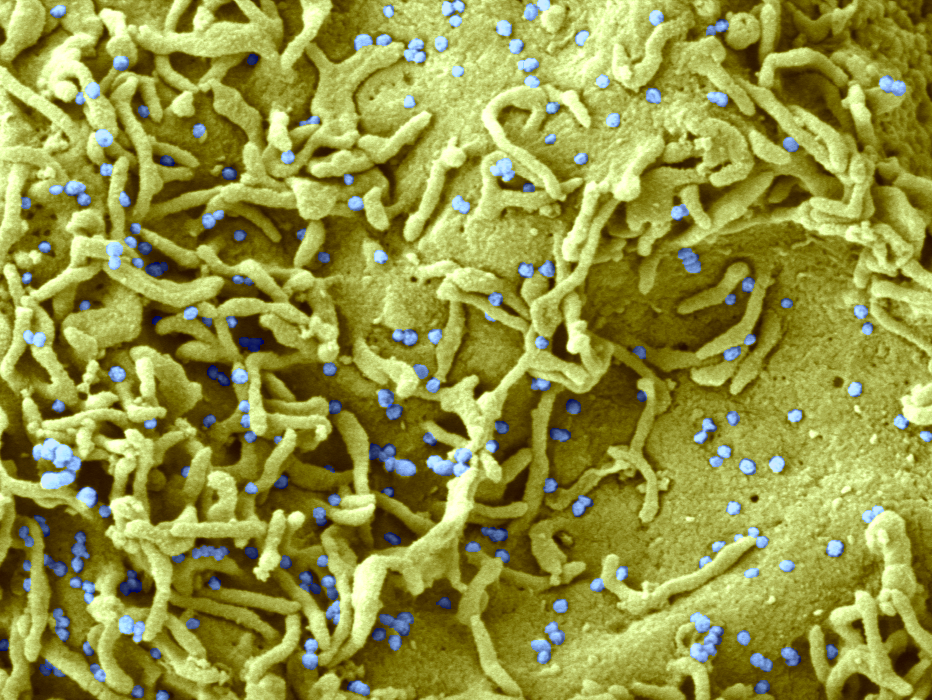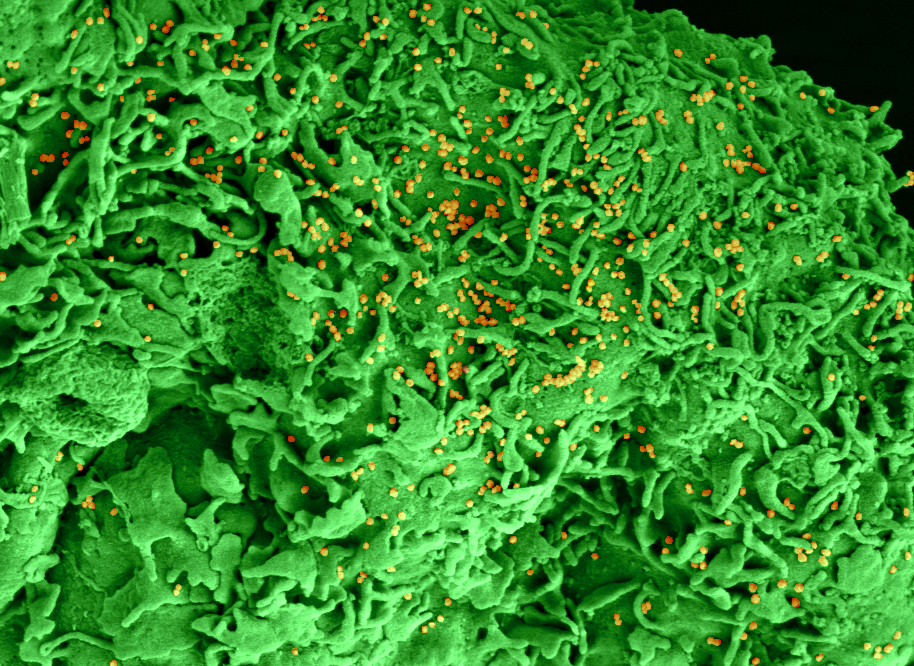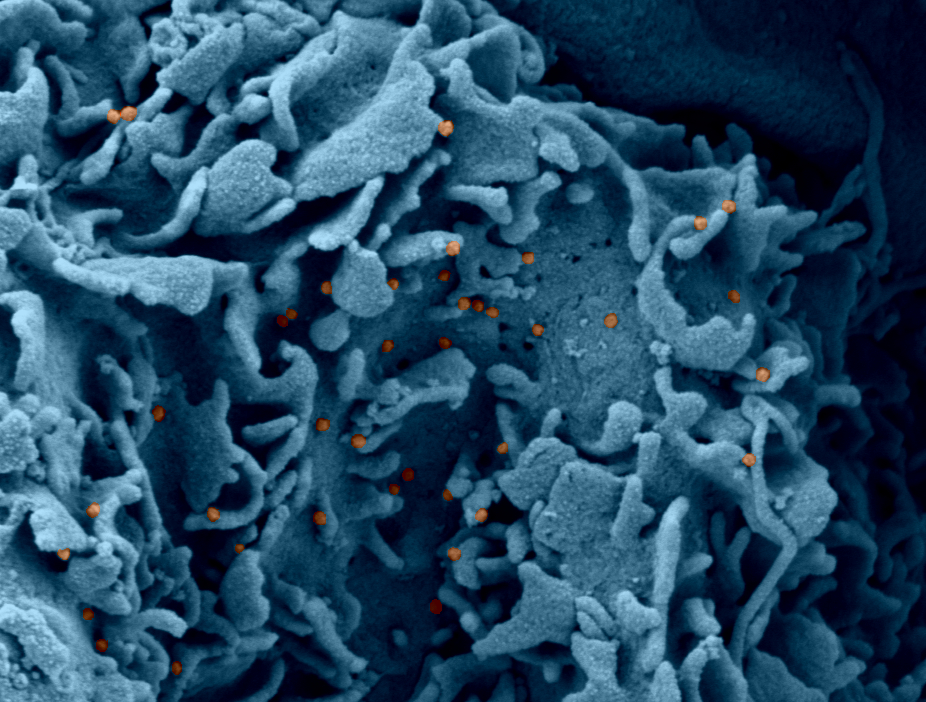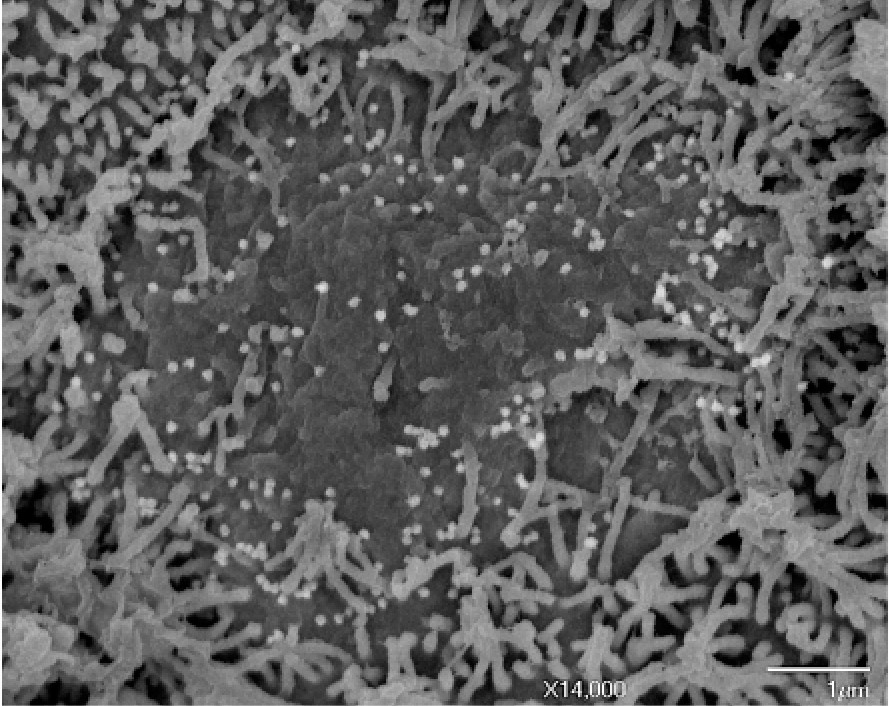
Microscopie électronique à balayage montrant les changements de l’épithélium olfactif après infection par le SARS-CoV-2. A la périphérie de la photo, les cellules ciliées sont normales. Au centre : perte de cils 2 jours après infection. Les particules virales bourgeonnent à la surface des cellules infectées ayant perdu leurs cils. © Unité Perception et Mémoire – Institut Pasteur
La perte de l’odorat, ou anosmie, est l’un des symptômes précoces les plus fréquents de la Covid-19. Les mécanismes impliqués dans cette anosmie étaient jusqu’ici non élucidés. Des chercheurs de l’Institut Pasteur, du CNRS, de l’Inserm, d’Université de Paris et de l’Assistance Publique – Hôpitaux de Paris, ont élucidé les mécanismes impliqués dans la perte d’odorat chez les patients infectés par le SARS-CoV-2 aux différents stades de la maladie. Ils ont découvert que le SARS-CoV-2 infecte les neurones sensoriels et provoque une inflammation persistante de l’épithélium et du système nerveux olfactif. Par ailleurs, chez certains patients porteurs de manifestations cliniques persistantes, l’anosmie présente est associée à une inflammation prolongée de l’épithélium et du système nerveux olfactif et à la présence durable du virus dans l’épithélium olfactif. Ces résultats ont été publiés dans la revue Science Translational Medicine, le 3 mai 2021.
La Covid-19, causée par le virus SARS-CoV-2 est principalement une maladie respiratoire mais de nombreux patients présentent des symptômes extra-respiratoires. Parmi ceux-ci, une perte soudaine de l’olfaction chez les personnes infectées par le SARS-CoV-2 a été signalée dans le monde entier dès le début de la pandémie. Le rôle direct du virus dans l’anosmie est resté jusqu’ici incertain. L’une des hypothèses communément admises jusqu’à ce jour était qu’un œdème transitoire au niveau des fentes olfactives empêchait le passage de l’air qui amène les molécules odorantes vers les cellules nerveuses olfactives (la fameuse sensation du « nez bouché » lors d’un rhume classique).
Dans une nouvelle étude, des chercheurs de l’Institut Pasteur, du CNRS, de l’Inserm et d’Université de Paris, de l’AP-HP, ont élucidé les mécanismes impliqués dans l’anosmie liée à la Covid-19. L’étude a été conduite auprès de patients ayant la Covid-19 et complétée grâce à des analyses sur un modèle animal. Cette étude montre de façon inattendue que les tests classiques RT-qPCR pratiqués sur les écouvillonnages nasopharyngés peuvent se révéler négatifs alors même que le virus persiste au fond des cavités nasales, dans l’épithélium olfactif. Cette découverte montre qu’un diagnostic du SARS-CoV-2 par brossage nasal peut être envisagé pour compléter l’écouvillonnage nasopharyngé du test PCR chez les patients présentant une perte d’odorat.
Ce travail élucide également le mécanisme de la perte de l’odorat liée à la Covid-19 en révélant, de manière chronologique, différentes étapes :
1) la disparition des cils portés par les neurones sensoriels, après l’infection virale. Or, ces mêmes cils permettent la réception des molécules odorantes par les neurones sensoriels ;
2) la présence de virus dans les neurones sensoriels ;
3) la désorganisation de l’épithélium olfactif (organe sensoriel) liée à l’apoptose (phénomène de mort cellulaire). L’épithélium est organisé en lamelles régulières qui se trouvent être déstructurées par l’infection au coronavirus ;
4) l’invasion du virus dans le premier relai cérébral du système olfactif, le bulbe olfactif ;
5) la présence d’une neuroinflammation et d’ARN viral dans plusieurs régions du cerveau.
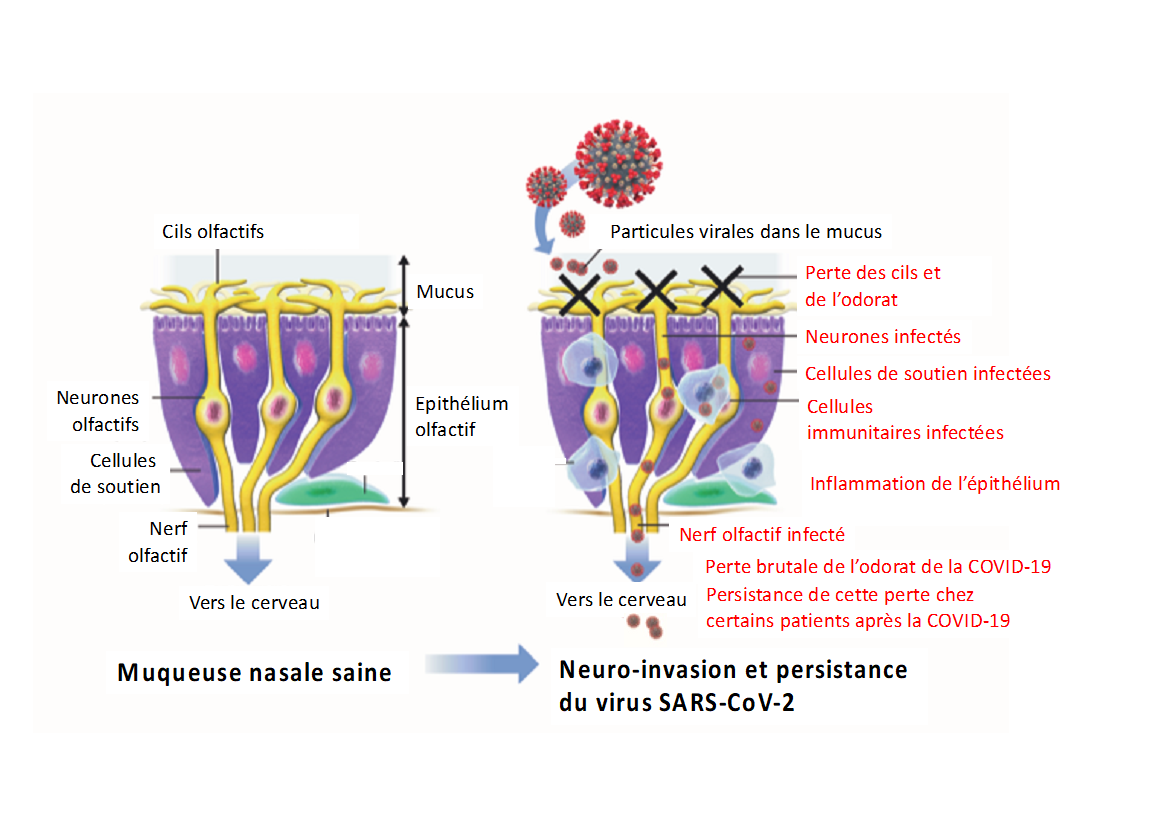
Schéma représentant les différentes étapes qui surviennent au niveau de l’appareil sensoriel et qui concourent à l’anosmie liée à la Covid-19.
Cette étude montre que la perte de l’odorat est aussi la conséquence d’une dégradation de l’organe sensoriel situé au fond des cavités nasales. « En effet nous avons constaté que les neurones sensoriels sont infectés par le SARS-CoV-2, mais aussi le nerf olfactif et les centres nerveux olfactifs dans le cerveau », commente Pierre-Marie Lledo, chercheur CNRS, responsable de l’Unité Perception et mémoire (Institut Pasteur/CNRS) et co-auteur responsable de l’étude.
« Un autre point important de cette étude tient à l’observation portée sur les modèles animaux qui révèle que le virus, une fois entré dans le bulbe olfactif, se propage à d’autres structures nerveuses où il induit une importante réponse inflammatoire », explique Hervé Bourhy, responsable de l’unité Lyssavirus, épidémiologie et neuropathologie à l’Institut Pasteur et co-auteur responsable de l’étude. L’infection des neurones olfactifs pourrait donc constituer une porte d’entrée vers le cerveau et expliquer pourquoi certains patients développent diverses manifestations cliniques, d’ordre psychologiques (troubles de l’anxiété, dépression) ou neurologiques (déclin cognitif, susceptibilité à développer une maladie neurodégénérative), qui doivent faire l’objet de nouvelles études.
Enfin, Marc Lecuit, responsable de l’unité Biologie de l’Infection (Institut Pasteur, Inserm, Université de Paris, AP-HP) et co-auteur responsable de l’étude, conclut : « Selon nos résultats, la perte de l’odorat dans la Covid-19 peut persister plusieurs mois chez certains patients, et cette persistance des signes cliniques est attribuable à la persistance du virus et de l’inflammation dans la muqueuse olfactive ». Ces éléments devront être pris en compte pour adapter le diagnostic et la prise en charge des manifestations à long-terme de la Covid-19.
En résumé, les 4 faits marquants de cette étude sont les suivants :
- Le brossage nasal révèle la présence du virus quand l’écouvillonnage ne le détecte pas ;
- Le SARS-CoV-2 peut persister au sein de l’épithélium olfactif pendant plusieurs mois ;
- Le SARS-CoV-2 infecte les neurones sensoriels et provoque un recrutement de cellules immunitaires dans l’organe sensoriel ;
- Le SARS-CoV-2 peut provoquer une inflammation persistante de l’épithélium olfactif et du système nerveux olfactif