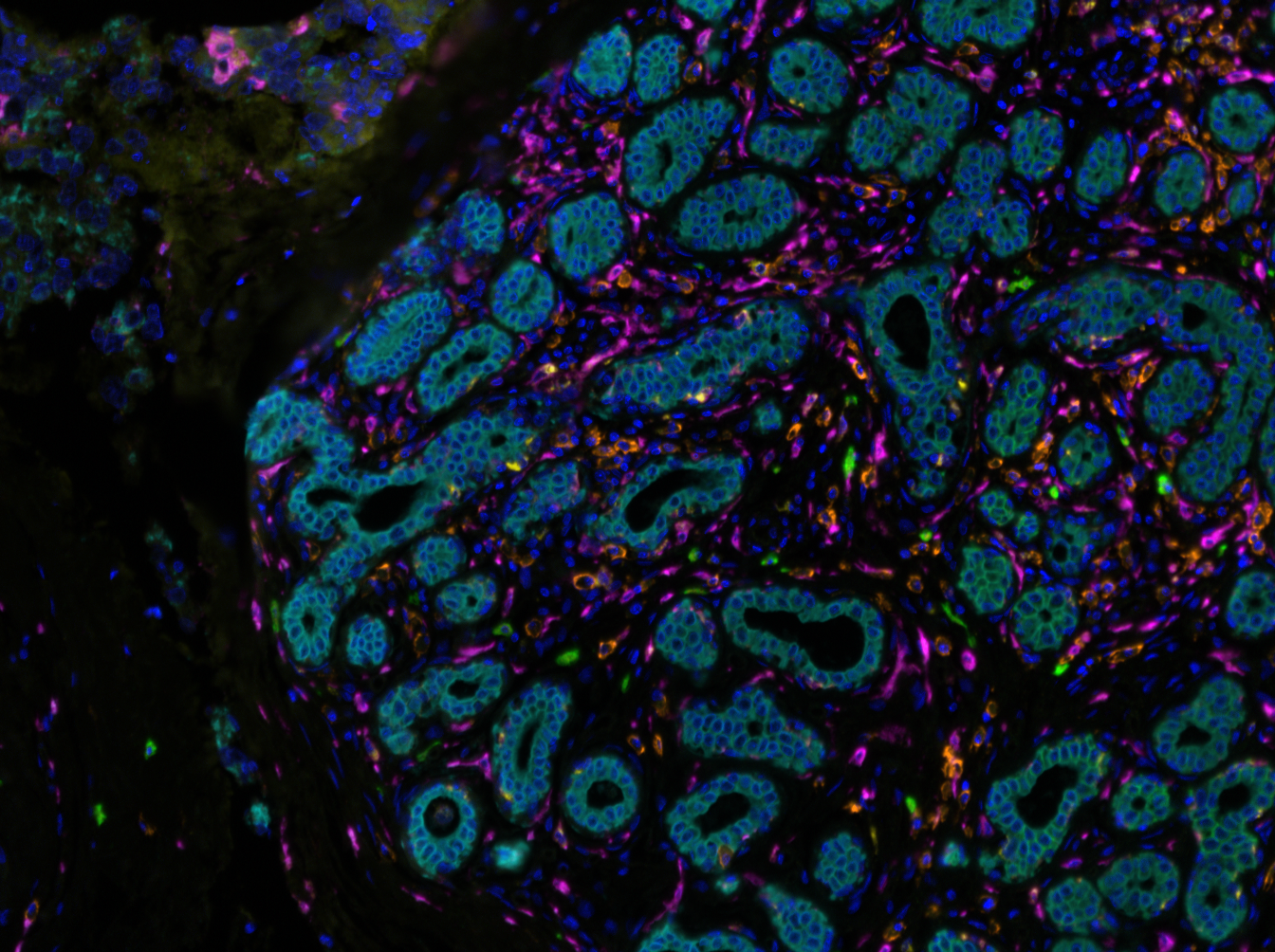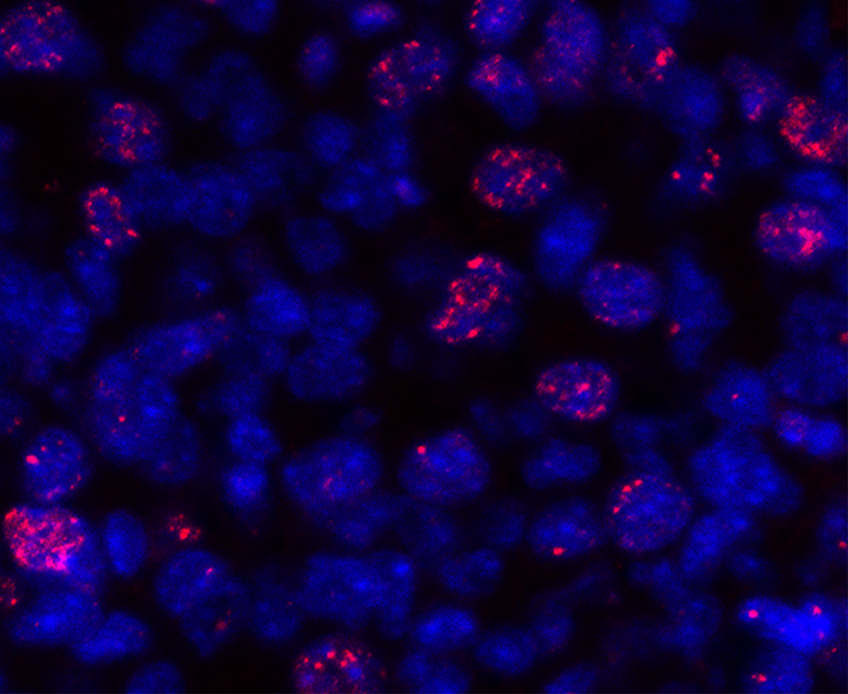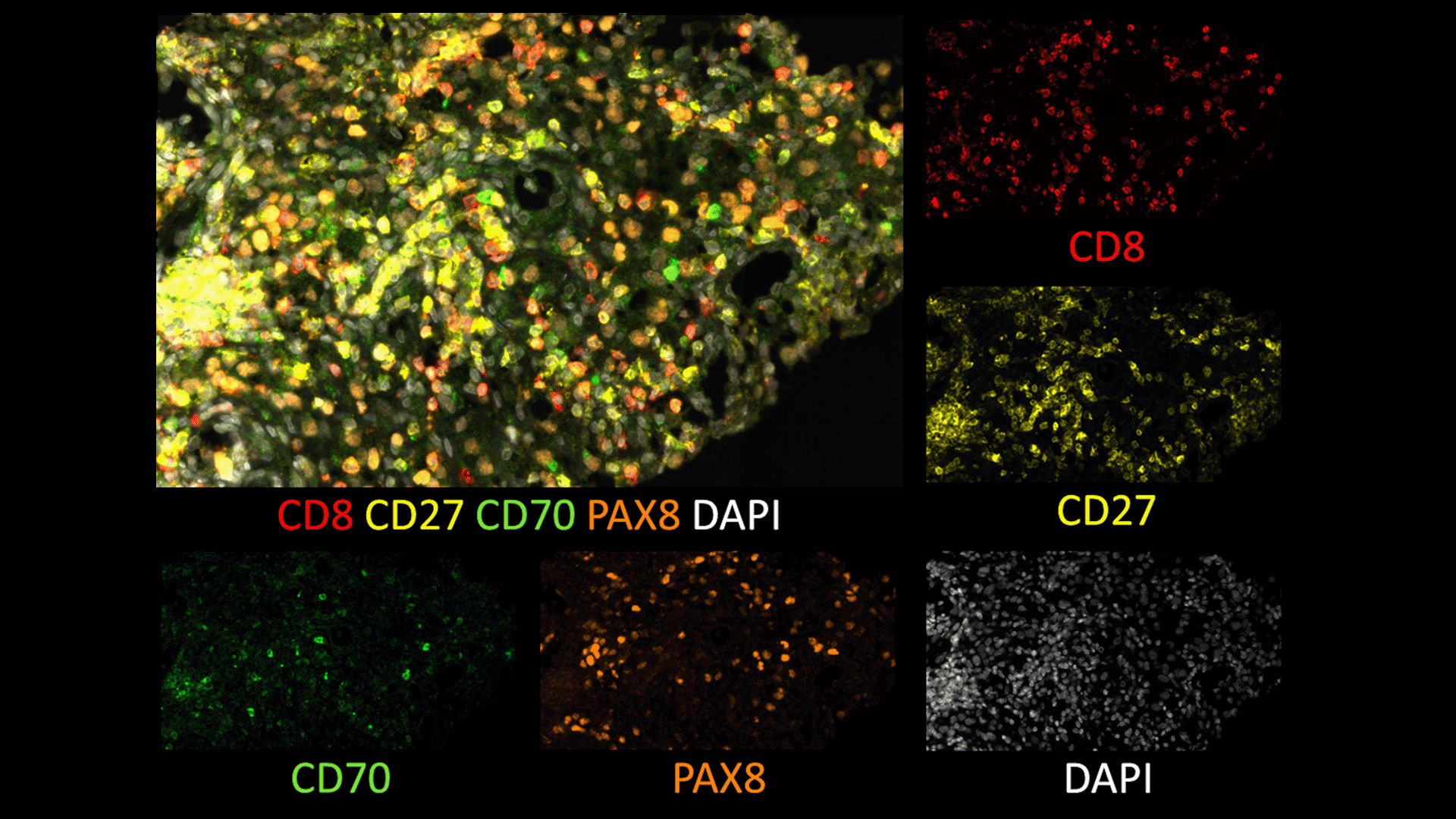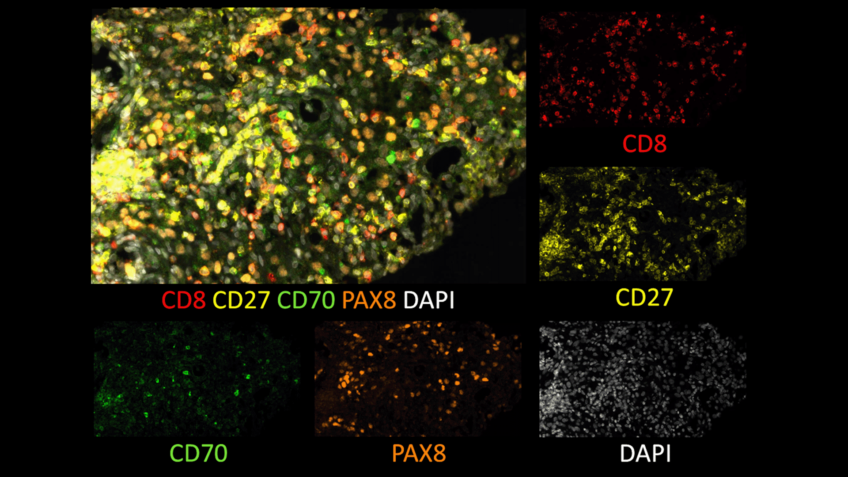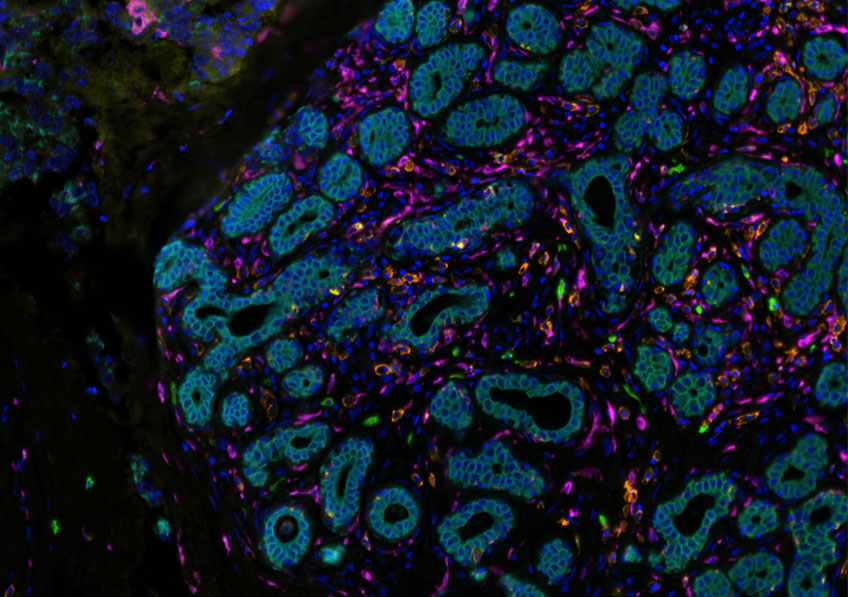
Marquage immunofluorescent sur les différents sous types de cellules immunitaires du microenvironnement tumoral (marquage CD68 (jaune) – CD 163 (violet) – CD138 (orange)– CKIT (vert)– AE1/AE3 (bleu clair). © Institut Curie
Cette étude menée par l’Institut Curie, en collaboration avec l’Inserm et le German Breast Cancer Group, est la première à décrire le cancer du sein bilatéral avec des technologies de séquençage aussi avancées. Si les deux tumeurs dans chaque sein sont d’origines différentes, le type de chaque tumeur (luminal, HER2, triple négatif) influe sur le microenvironnement tumoral dans l’autre sein, notamment le système immunitaire, et modifie la réponse au traitement. Publiés dans Nature Medicine le 6 mars 2023, ces travaux ouvrent des perspectives cliniques pour améliorer la prise en charge des patientes atteintes de cancer du sein bilatéral.
Le cancer du sein bilatéral concerne entre 2 et 11% de l’ensemble des cancers du sein, avec une incidence qui ne cesse d’augmenter. Il se caractérise par la survenue d’une tumeur dans chacun des deux seins, soit exactement au même moment, soit dans un laps de temps d’environ six mois. Jusqu’à présent, le cancer du sein bilatéral n’a pas été associé à un fort déterminant génétique.
Menés à l’Institut Curie par le Dr Joshua Waterfall, chercheur Inserm et chef d’équipe dans l’unité « Cancer, Hétérogénéité, Instabilité et Plasticité » (Inserm/Institut Curie), le Pr Fabien Reyal, chef de service de chirurgie gynécologique sénologique et reconstructrice et le Dr Anne-Sophie Hamy-Petit, oncologue et chercheuse à l’Institut Curie dans l’équipe Résidu tumoral et réponse au traitement, ces travaux portent sur une cohorte de 17 500 patientes de tous âges dont 404 étaient porteuses d’un cancer du sein bilatéral (soit 2 %).
Dans un premier temps, l’équipe de recherche a analysé l’ensemble des 17 500 dossiers médicaux. Elle a ainsi caractérisé la nature des tumeurs mais également observé la réponse du système immunitaire et la réponse à un traitement néoadjuvant (administré aux patientes avant la chirurgie). Chercheurs et médecins ont alors découvert que le système immunitaire ne réagissait pas de la même manière si les tumeurs droites et gauches étaient de sous-groupes différents (luminal, triple négatif ou HER2).
« Un exemple : les cancers du sein de type luminal[1] ne répondent habituellement pas au traitement néoadjuvant, mais en présence d’une tumeur controlatérale de type triple négatif la réponse immunitaire et la réponse au traitement sont augmentées », explique Joshua Waterfall. « Un mécanisme systémique, pour lequel il n’y a pas encore d’explication ».
Dans un deuxième temps, une plus petite cohorte de 6 patientes a été analysée : leurs tumeurs ont été caractérisées sur le plan génomique, en comparant les profils des patientes avant et après le traitement néoadjuvant. Grâce à un séquençage nouvelle génération, l’équipe est parvenue à observer l’ordre des nucléotides dans le génome entier ou dans certaines régions spécifiques de l’ADN ou de l’ARN.
« Cette technologie de pointe nous a permis de montrer que, du point de vue des mutations génétiques, les deux tumeurs sont complètement indépendantes l’une de l’autre », explique Joshua Waterfall.
Malgré un outil de séquençage très complet, la taille très réduite du groupe de patientes rend impossible la recherche d’un gène commun à toutes ces tumeurs.
« C’est une possibilité que nous ne pouvons pas éliminer mais nous ne voyons aucun élément qui va dans ce sens. Les tumeurs bilatérales ont beau ne pas être rares, leur survenue s’avère indépendante et peut être attribuée à la malchance », poursuit Joshua Waterfall.
Indépendantes d’un point de vue génomique, en termes de mutations, de copies d’altérations et d’expression, leur survenue pourrait être influencée par des facteurs du microenvironnement dans les cellules et les tissus.
Ces nouveaux résultats permettent de mieux comprendre comment traiter les patientes atteintes d’un cancer du sein bilatéral. En effet, les chercheurs et médecins qui signent ces travaux recommandent de considérer ces tumeurs comme deux entités différentes avant de décider d’un traitement qui les cibleraient toutes les deux.
« Étant donné que les deux tumeurs sont indépendantes mais peuvent avoir une influence l’une sur l’autre, le choix du traitement peut s’avérer complexe. Nous espérons que nos résultats pourront guider les soignants dans leurs décisions et améliorer la prise en charge des patientes », espère Joshua Waterfall.
[1] Le cancer du sein de type luminal est la forme la plus fréquente de cancer du sein, caractérisée par l’expression du récepteur œstrogène.