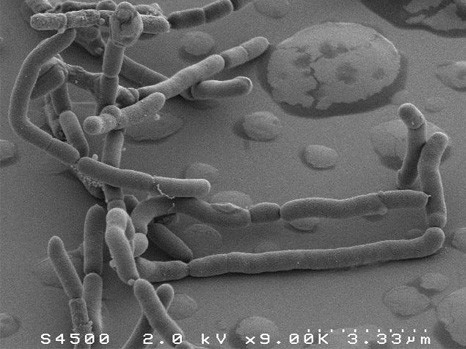
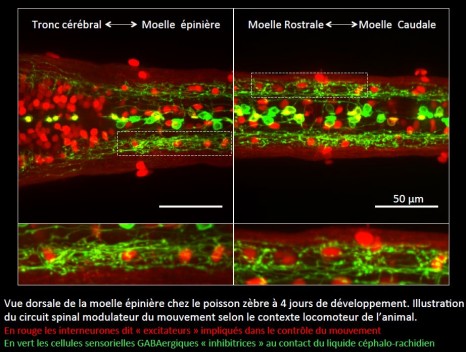
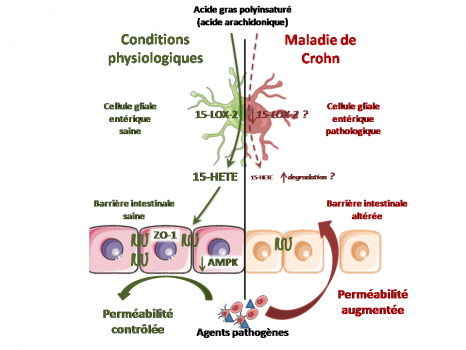
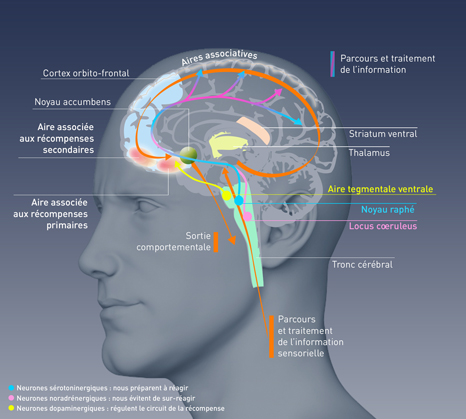
La bactérie Faecalibacterium prausnitzii est abondante dans l’intestin des personnes en bonne santé mais diminue dès l’apparition d’une maladie inflammatoire chronique de l’intestin. Une équipe impliquant l’Inra, l’Inserm et l’Université d’Auvergne révèle, chez l’animal, les propriétés antalgiques de cette bactérie. En plus des propriétés anti-inflammatoires déjà connues de F. prausnitzii, ces résultats publiés dans Scientific Reports le 18 janvier 2016, confirment son potentiel bénéfique pour le bien-être et la santé humaine.
Image en microscopie électronique à balayage de F. prausnitzii (c) Plateforme MIMA 2, T. Meylheuc
Les douleurs abdominales chroniques sont un des symptômes fréquemment retrouvés chez des patients présentant des atteintes intestinales telles que le Syndrome de l’Intestin Irritable (SII) ou une Maladie Inflammatoire Chronique de l’Intestin (MICI). En 2008, des chercheurs de l’Inra de Jouy-en-Josas ont montré que chez des patients souffrant d’une MICI, l’abondance de la bactérie Faecalibacterium prausnitzii diminue dans l’intestin.
En collaboration avec deux autres équipes françaises impliquant l’Inra, l’Inserm et l’Université d’Auvergne, ces chercheurs ont mis en évidence, grâce à des modèles animaux de stress (développant une hypersensibilité viscérale d’origine colique), qu’une diminution de l’abondance de F. prausnitzii était liée à l’apparition d’une hypersensibilité viscérale. Or, chez l’homme, une telle hypersensibilité peut se traduire par un inconfort intestinal ou des douleurs abdominales. Les scientifiques ont démontré qu’en administrant F. prausnitzii à ces animaux, ils retrouvaient une sensibilité colique normale.
La bactérie F. prausnitzii pourrait donc présenter, chez l’homme, des propriétés antalgiques, venant s’ajouter à ses propriétés anti-inflammatoires décrites précédemment.
Chez les patients souffrant d’une MICI ou du SII, la diminution de la présence de F. prausnitzii au niveau colique suite à une inflammation intestinale ou à un stress chronique pourrait participer à l’aggravation des symptômes inflammatoires et/ou douloureux au niveau viscéral. De façon à entraver ce cercle vicieux, les scientifiques envisagent désormais de restaurer le « bien-être intestinal » grâce à de nouveaux compléments alimentaires (probiotiques) contenant F. prausnitzii.
Par ailleurs, ces travaux, qui viennent enrichir notre connaissance fondamentale dans le domaine de la microbiologie cellulaire, sont aussi à l’interface de nouvelles applications industrielles et médicales.