A l’Institut Curie, des médecins et des chercheurs de l’Inserm viennent de mettre en évidence une « signature ADN » – un ensemble d’altérations du matériel génétique – prédictive du risque de récidive chez les femmes atteintes de cancer du sein. A partir d’un prélèvement de quelques cellules tumorales, il est désormais envisageable d’identifier les patientes porteuses de cette « signature » et dont le risque de développer des métastases est élevé. Publiée dans Genes Chromosomes and Cancer, cette signature « Curie » va permettre de prescrire une chimiothérapie aux femmes qui en ont réellement besoin, en épargnant aux autres un traitement inutile.
Grâce au développement du dépistage, les tumeurs du sein de petite taille, sans envahissement ganglionnaire, concernent la grande majorité des patientes diagnostiquées. Chez ces femmes, une question cruciale se pose quant au choix thérapeutique : doit-on, après traitement local (chirurgie et/ou radiothérapie), leur prescrire une chimiothérapie pour réduire le risque de récidive ? On sait qu’environ 20 % des patientes porteuses d’une tumeur de petite taille sans envahissement ganglionnaire en aura réellement besoin car leur tumeur est agressive, tandis que pour les autres, la chimiothérapie sera inutile. L’enjeu majeur est donc de distinguer les 2 groupes de tumeurs dès le diagnostic.
Pour le moment, la décision des médecins repose sur des critères biologiques et cliniques : âge au diagnostic, taille de la tumeur, grade, statut des récepteurs hormonaux et du récepteur HER2.
C’est au coeur des cellules tumorales, dans leur matériel génétique, qu’une équipe réunissant médecins, ingénieurs et chercheurs de l’Inserm à l’Institut Curie est allée trouver le moyen de distinguer les patientes à faible et à fort risque métastatique.
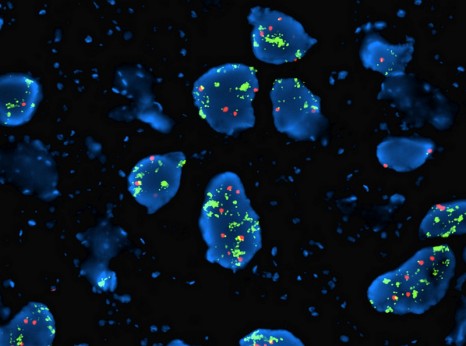
Détection d’anomalies chromosomiques tumorales © Inserm, D. Pissaloux
Ils ont étudié les altérations génétiques présentes dans les échantillons biologiques prélevés chez 168 patientes porteuses de cancers du sein en majorité de type luminal (1), de taille inférieure à 3 cm, sans envahissement ganglionnaire, diagnostiquées entre 1989 et 1999. Ces tumeurs étaient répertoriées dans le Centre de Ressources Biologiques de l’Institut Curie, créé en 1988 par le Dr Xavier Sastre-Garau (2), et qui est l’une des plus grandes banques de tissus et de matériel génétique tumoraux en Europe avec près de 50 000 échantillons biologiques. A chaque tumeur conservée, est associée l’information médicale sur son évolution. Ensuite, les données génétiques issues des prélèvements tumoraux ont été analysées avec l’aide des équipes de biostatisticiens et de bioinformaticiens (3) dirigées par le Dr Bernard Asselain et Emmanuel Barillot de l’Institut Curie.
« Nous avons ainsi pu distinguer deux groupes de patientes selon la nature des profils et le nombre d’altérations génétiques survenant dans leurs tumeurs du sein : un à bon pronostic et un à mauvais pronostic » précise le Dr Anne Vincent-Salomon (4), médecin pathologiste et chercheur dans l’unité du Dr Olivier Delattre, à l’Institut Curie. Les patientes de bon pronostic sont celles n’ayant pas développé de métastases 5 ans après le diagnostic.
« Nous nous sommes focalisés sur la recherche d’une signature ADN, c’est-à-dire des anomalies du nombre de chromosomes dans les tumeurs, pouvant prédire l’apparition de métastases dans les tumeurs du sein sans envahissement des ganglions lymphatiques, et sans jamais perdre de vue que cette analyse devait être facilement utilisable en routine clinique » ajoute le Dr Anne Vincent-Salomon.
La signature « Curie » comporte des modifications dans 3 régions chromosomiques différentes (des gains au niveau des chromosomes 2 et 8 et une perte sur le chromosome 3) et prend en compte le nombre d’altérations génomiques. Pour les détecter, l’équipe d’Olivier Delattre (5) a eu recours aux puces dites CGHarray (voir encadré). A partir d’un prélèvement de quelques cellules tumorales déposées sur cette puce, il est possible de rechercher dans l’ensemble du génome les pertes ou les gains de matériel génétique.
Les puces CGH-array : un outil idéal pour analyser le génome Le principe des puces CGH-array est de mettre en compétition de l’ADN tumoral et de l’ADN normal que l’on distingue grâce à un marquage avec des molécules fluorescentes de couleurs différentes (prenons par exemple, des marquages respectivement rouge et vert). Ces deux types d’ADN s’hybrident avec les sondes, ce qui se traduit par l’apparition de spots luminescents. Le rapport entre les deux fluorescences est analysé par un logiciel : il permet de déterminer quel ADN s’est le plus fixé. Lorsque le rouge domine, cela signale un excès d’ADN tumoral : il y a eu une amplification dans la région considérée. Quand le vert est majoritaire, seul l’ADN normal s’est fixé : il y a un défaut d’ADN tumoral à cet endroit et donc une délétion. Quand les deux couleurs sont en quantité équivalente, il n’y a ni perte ni gain à cet endroit dans l’ADN tumoral.
Il s’agit d’une signature basée sur des altérations du génome des cellules tumorales, contrairement à la signature utilisée dans l’étude Mindact à laquelle participe l’Institut Curie (6) et qui s’intéresse aux modifications dans l’expression des gènes.
De même que plusieurs paramètres sont à ce jour utilisés par les pathologistes pour caractériser les cancers, ces signatures sont complémentaires et leur utilisation conjointe ne pourra qu’affiner le pronostic individualisé des cancers.
« Avec cette signature, nous devrions être à même de mieux prédire le risque de survenue de métastases chez les patientes ne présentant aucun signe avant-coureur d’un risque de dissémination » précise le Dr Anne Vincent-Salomon.
« Ce travail montre que l’ADN des cellules tumorales est clairement porteur d’informations importantes concernant le risque évolutif de la tumeur. Des travaux à venir seront nécessaires pour décrypter ces informations » conclut le Dr Olivier Delattre, directeur de recherche à l’Inserm.
Ces résultats devront être confirmés par des études complémentaires, à une plus grande échelle, et en prospectif. Il sera alors possible de proposer ce test pour aider les cancérologues dans leurs choix thérapeutiques. Dans les années à venir, ce test pourra être utilisé au cas par cas pour des tumeurs du sein pour lesquelles les indications de chimiothérapie sont délicates à poser avec les outils pronostiques disponibles en routine. Mais pour consolider nos résultats, une autre étude est en cours de réalisation pour valider cette signature sur une autre population de patientes.
Notes
(1) Les cancers du sein dit « luminaux » représentent plus de la moitié des cancers du sein. Ils se développent à l’intérieur des canaux ou des lobules, petites structures en forme de bulles qui fabriquent le lait
(2) Le Dr Xavier Sastre-Garau est chef du département de Biologie des tumeurs
(3) Equipe de Biostatisques dirigée par Bernard Asselain et Unité Cancer et génome : bioinformatique, biostatistiques et épidémiologie d’un système complexe – Institut Curie / Unité 900 Inserm / Ecole des Mines dirigée par Emmanuel Barillot
(4) Le Dr Anne Vincent-Salomon, pathologiste dans le département de Biologie des tumeurs de l’Institut Curie, a réalisé ce travail au cours de sa thèse de sciences effectuée notamment grâce à un contrat INTERFACE Inserm lui permettant de se consacrer à la recherche pendant qu’un autre médecin assure ses activités médicales
(5) Unité de Génétique et Biologie des cancers, Institut Curie/U830 Inserm, dirigée par le Dr Olivier Delattre, à laquelle appartient Gaëlle Pierron qui coordonne cette étude pour l’unité
(6) Cette étude internationale vise à comparer la signature moléculaire établie par le Netherlands Kancer Institute d’Amsterdam – plus connue sous le nom de MammaPrint® – qui tient compte de l’expression de 70 gènes, aux facteurs clinico-pathologiques classiques permettant de prédire l’agressivité d’une tumeur sans envahissement ganglionnaire.