Développer un vaccin efficace contre l’hépatite C : tel est l’objectif d’une étude européenne coordonnée par David Klatzmann du laboratoire Immunologie-immunopathologie-immunothérapeutique (CNRS/UPMC/Inserm) et soutenue par l’ANRS. Pour la première fois, les chercheurs sont parvenus à produire chez l’animal des anticorps à large spectre contre le virus de l’hépatite C. Publiés le 3 août 2011 dans la revue Science Translational Medicine, ces résultats ouvrent la voie à la mise au point d’un vaccin contre l’hépatite C et plus largement, vers une nouvelle technologie pour le développement de vaccins contre d’autres infections (VIH, dengue…).
L’infection par le virus de l’hépatite C (VHC) est un problème de santé publique majeur. Dans le monde, 200 millions de personnes sont chroniquement infectées et, dans certaines régions, 10 à 30 % de la population est touchée. Les complications majeures de l’infection par le VHC (comme l’insuffisance hépatique ou les cancers du foie) provoquent environ 50 000 morts par an au niveau mondial. L’OMS estime que sans intervention rapide pour contenir la propagation de l’infection, la mortalité liée à l’infection par le VHC pourrait dépasser celle causée par le VIH. Il existe des traitements antiviraux qui permettent d’éradiquer le virus mais ils sont très coûteux et peu accessibles aux pays du Sud et il n’y a pas encore de vaccin préventif de l’infection dont le besoin est pourtant manifeste.
Dans le cadre d’une étude européenne coordonnée par David Klatzmann du laboratoire Immunologie-immunopathologie-immunothérapeutique (CNRS/UPMC/Inserm) et soutenue par l’ANRS, la start-up Epixis révèle les résultats prometteurs d’une nouvelle stratégie de développement vaccinal obtenus par plusieurs équipes françaises (1).
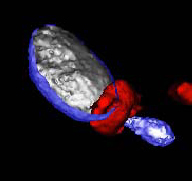
Dans le but de développer un vaccin contre le VHC, les chercheurs ont mis au point une technologie basée sur l’utilisation de « pseudo-particules » virales. De telles structures artificielles ressemblent aux particules virales mais elles n’en n’ont pas la dangerosité puisqu’elles ne contiennent pas de matériel génétique et ne permettent pas au virus de se multiplier (2). La nouveauté de l’étude réside dans l’élaboration de pseudo-particules virales « chimériques », c’est-à-dire construites avec des fragments issus de deux virus différents. Ici, il s’agit d’une pseudo-particule issue d’un rétrovirus de souris recouverte de protéines du VHC.
En réaction à une vaccination avec ces pseudo-particules virales, les chercheurs ont observé, pour la première fois, la production d’anticorps neutralisants le virus VHC chez la souris et le macaque. Il est largement accepté que les anticorps neutralisants sont les principaux médiateurs d’une immunité protectrice pour la plupart des vaccins utilisés chez l’homme.
Ces mêmes anticorps se sont révélés avoir une activité à large spectre, c’est-à-dire capables d’induire une immunité neutralisante contre les différents sous-types du VHC. Jusqu’à présent, les tentatives dans ce sens avaient échoué.
Ces résultats sont importants pour la mise au point d’un vaccin préventif contre le virus de l’hépatite C. Plus généralement, ils sont applicables au développement de stratégies similaires pour des vaccins contre d’autres infections, comme le VIH, la dengue, leVirus Respiratoire Syncytial (RSV)…
Ces travaux ont été soutenus par l’ANRS et par un contrat de recherche européen « CompuVac » financé dans le cadre du 6ème Programme-cadre de recherche et de développement (PCRD). Ils impliquent 18 partenaires européens dont le CNRS, l’UPMC, l’ENS de Lyon, l’Institut Pasteur, le CEA, l’Inserm, l’Université Claude Bernard – Lyon 1, la société Epixis.

© D. Klatzmann/CNRS Schéma illustrant les pseudo-particules virales chimériques utilisées dans l’étude
Notes
(1) Ont notamment été impliquées dans cette étude : des équipes du laboratoire Immunologie-immunopathologie-immunothérapeutique (CNRS/UPMC/Inserm), du laboratoire de virologie humaine (Inserm/Université Claude Bernard Lyon 1/ENS Lyon), de l’Unité de génomique virale et vaccination (CNRS/Institut Pasteur), du service d’immunovirologie (CEA/Université Paris-Sud 11).
(2) L’utilisation de pseudo-particules virales est bien connue et appliquée, par exemple dans le vaccin contre le papillomavirus.