Depuis 2011, près de 7 000 enfants prématurés ont été inclus dans l’étude EPIPAGE 2. Cette étude pour objectif d’évaluer la survie des enfants prématurés nés entre la 22ème semaine et la 34ème semaine d’aménorrhée et leur devenir ultérieur. Comparée aux données de la cohorte EPIPAGE 1 en 1997, la proportion des enfants nés en 2011 à partir de la 25ème semaine d’aménorrhée, ayant survécu sans être atteint par une pathologie néonatale sévère, a nettement augmenté. Néanmoins, la survie est toujours rare pour les enfants nés avant 25 semaines. Ces résultats permettent de dresser le pronostic des enfants grands et très grands prématurés et de faire le bilan des changements survenus ces 15 dernières années. Ils fournissent des informations utiles aux équipes médicales dans la prise en charge des enfants et l’accompagnement des familles.
Cette étude réalisée par les chercheurs de l’équipe Inserm EPOPé -« Equipe de Recherche en Epidémiologie Obstétricale, Périnatale et Pédiatrique » du Centre de Recherche Epidémiologie et Statistique Sorbonne Paris Cité (CRESS, Unité 1153 Inserm/Université Paris Descartes)- est publiée dans la revue JAMA Pediatrics.
©Fotolia
L’étude EPIPAGE 2 (Etude épidémiologique sur les petits âges gestationnels) est une étude nationale pour mieux connaître le devenir des enfants prématurés au regard des évolutions survenues ces 15 dernières années. Elle est menée dans 25 régions de France. Entre le 28 mars 2011 et le 31 décembre 2011, près de 7000 enfants prématurés (mort-nés et naissances vivantes) ont été inclus dans EPIPAGE 2. Des informations en maternité et dans les services de néonatologie ont été collectées par les équipes médicales et de recherche des 25 régions participantes.
La durée moyenne normale d’une grossesse est de 40 semaines. On considère qu’un enfant naît prématurément avant 37 semaines d’aménorrhée (avant le début du 9ème mois de grossesse), la grande prématurité se situant entre 22 semaines (5 mois) et 31-32 semaines (7 mois).
Dans cette étude, trois groupes d’enfants prématurés ont été constitués :
– les enfants extrêmement prématurés (nés avant la fin du 6ème mois de grossesse, entre 22 et 26 semaines d’aménorrhée révolues)
– les enfants grands prématurés (nés avant la fin du 7ème mois de grossesse, entre 27 et 31 semaines d’aménorrhée révolues)
– les enfants modérément prématurés (nés au début du 8ème mois de grossesse, entre 32 et 34 semaines d’aménorrhée révolues)
Les résultats d’EPIPAGE 2 ont montré que 0.44% des naissances se produisaient avant 27 semaines en France, 0.84% entre 27 et 31 semaines et 1.8% à 32-34 semaines.
Après analyse, les données de 2011 montrent que plus les enfants sont prématurés, plus le taux de survie diminue. Ainsi, la survie atteint 99% à 32-34 semaines, 94% à 27-31 semaines, 60% à 25 semaines et moins de 1% avant 24 semaines.
Les enfants prématurés étant à haut risque de complications néonatales, cérébrales, respiratoires et digestives en particulier, les taux de survie sans pathologie néonatale grave sont plus faibles. Ils atteignent 97% à 32-34 semaines, 81% à 27-31 semaines, 30% à 25 semaines et 12% à 24 semaines.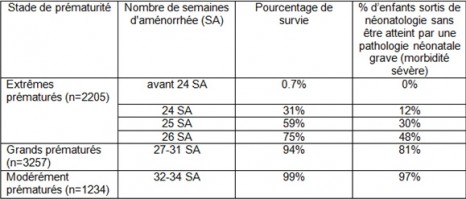
C’est à partir de la 25ème semaine que les chercheurs constatent une amélioration significative de la survie des enfants prématurés depuis ces 15 dernières années.
« Nous observons une importante augmentation du taux de survie chez les enfants de la cohorte EPIPAGE 2 nés en 2011. Comparée à 1997 (première étude EPIPAGE), la proportion des enfants ayant survécu sans morbidité sévère a augmenté de 14% pour les prématurés nés entre la 25ème et la 29ème semaine et de 6% pour les enfants nés entre 30 et 31 semaines d’aménorrhée« explique Pierre-Yves Ancel, responsable de l’équipe Inserm d’Epidémiologie Obstétricale, Périnatale et Pédiatrique à l’origine de l’étude. Ces données suggèrent donc une amélioration de la prise en charge des enfants prématurés en 15 ans.
Les résultats chez les enfants les plus immatures ont en revanche peu évolué. Ils traduisent une grande incertitude sur le devenir de ces enfants et la prise en charge à proposer. Les résultats d’EPIPAGE 2 pourraient être l’occasion d’une réflexion sur la prise en charge des plus petits. Cette réévaluation devra prendre en compte la « morbidité » et les séquelles à long termes.
« Les données recueillies par l’étude EPIPAGE 2 sont précieuses pour définir les besoins de prise en charge spécifiques pendant l’enfance et mieux connaître les conséquences de la prématurité »,
concluent les chercheurs.
Site internet de l’étude Inserm EPIPAGE 2 : http://epipage2.inserm.fr/index.php/fr/ A ce jour, plus de 4 000 enfants sont suivis dans le cadre de l’étude. Les familles ont complété des questionnaires à 1 et 2 ans. A l’âge de 2 ans, des informations ont également été recueillies auprès du médecin en charge du suivi médical de chaque enfant. La prochaine étape importante est le suivi à 5 ans. Cette étape vise à faire un bilan complet de la santé et du développement des enfants dans des centres prévus à cet effet.
© Inserm / Pierre Yves Ancel