Crédits: AdobeStock
Des chercheurs de l’Inserm, du CNRS et de Sorbonne Université au sein du laboratoire Neuroscience Paris-Seine[1] en collaboration avec l’Institut Pasteur[2], l’Université de New York (NYU) et l’Université de Californie Berkeley (UC Berkeley) ont réussi à contrôler l’activité des récepteurs à la nicotine dans le cerveau de souris. Pour cela, ils ont développé une stratégie de pharmacologie optogénétique permettant de bloquer avec la lumière les récepteurs nicotiniques, avec, à la clé, la possibilité de contrôler les effets addictifs de la nicotine. Cette étude est publiée dans eLIFE le 4 septembre 2018.
Chaque année, dans le monde, plus de 7 millions de personnes meurent du tabagisme. La nicotine, principal agent addictif du tabac, agit sur le cerveau en se liant sur les récepteurs nicotiniques. A ce jour, les techniques de pharmacologie classique ne permettent pas d’agir de manière précise et réversible sur ces récepteurs. C’est pourquoi des chercheurs ont eu l’idée de fabriquer des outils moléculaires capables d’interrompre le fonctionnement de ces récepteurs dans le cerveau avec la lumière.
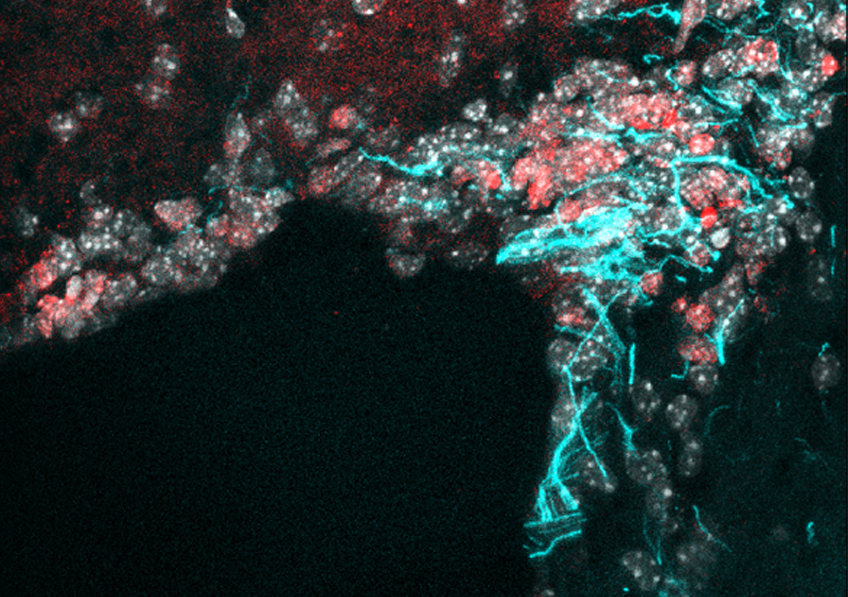
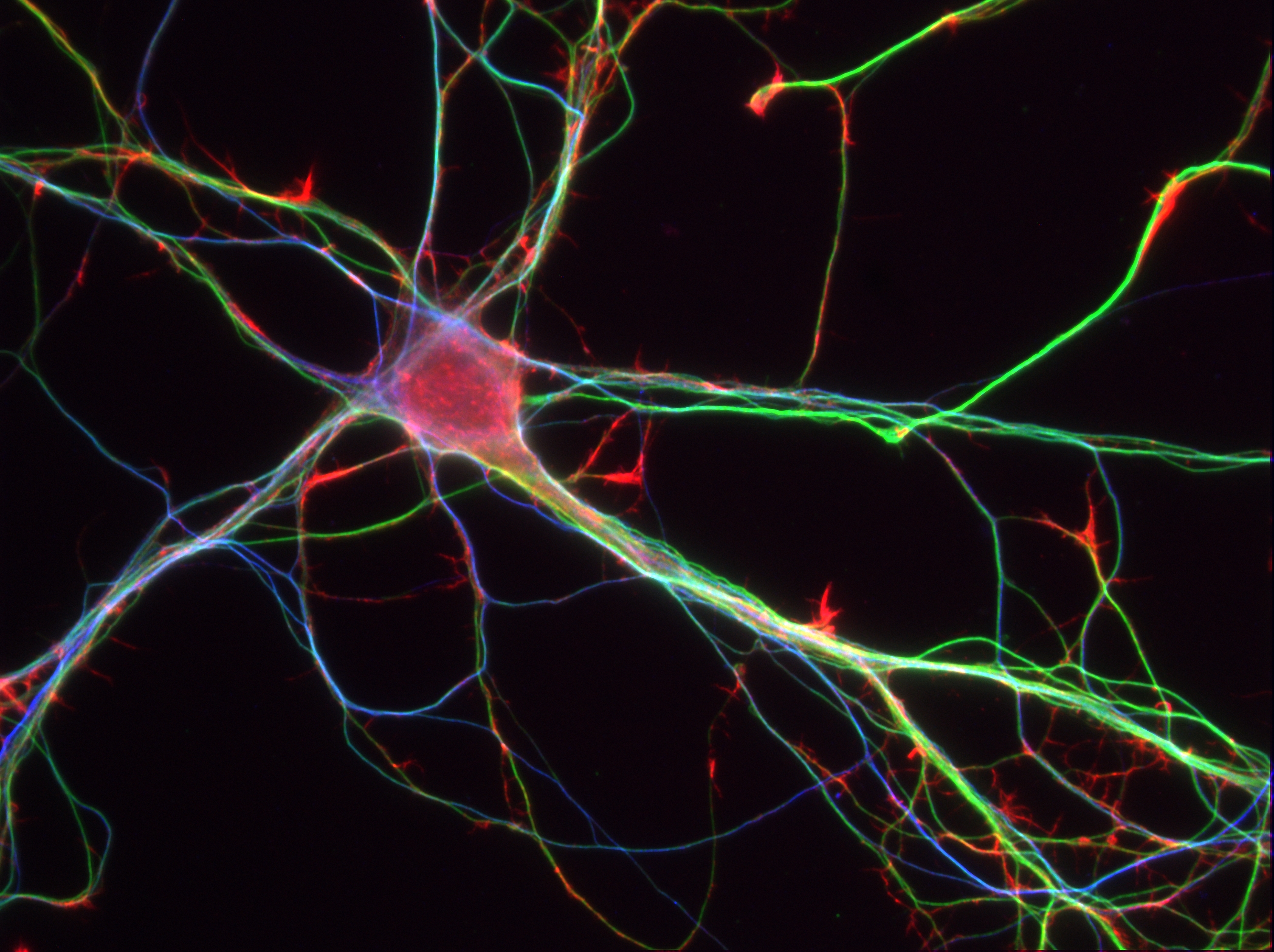
Dans cette étude, les chercheurs ont modifié le récepteur nicotinique chez la souris, afin de pouvoir y accrocher un nano-interrupteur chimique réagissant à la lumière. Sous l’effet de la lumière violette, l’interrupteur se replie en empêchant la nicotine de se fixer : le récepteur est « off ». Sous l’effet de la lumière verte, ou dans l’obscurité, l’interrupteur est déplié et va ainsi laisser la nicotine agir : le récepteur est « on ».
Pour cette étude, les chercheurs se sont focalisés sur un récepteur nicotinique particulier, le type b2, et sur une zone clé du circuit de la récompense, délivrant la dopamine. Lors d’une injection intraveineuse de nicotine, les neurones à dopamine répondent par une augmentation de leur activité électrique, la libération de dopamine qui en découle est la clé de la mise en place de l’addiction. Dans ce travail, cet effet de la nicotine s’est trouvé fortement réduit lorsque le nano-interrupteur est enclenché par la lumière violette, mais a pu être restauré rapidement sous lumière verte.
Les chercheurs ont ensuite démontré qu’il était possible d’inhiber l’attrait pour la nicotine en enclenchant cet interrupteur.
Pour ce faire, ils ont comparé le temps que passaient des souris dans deux compartiments avec ou sans nicotine. Sous lumière verte, lorsque la nicotine peut exercer son effet, ils ont observé que les animaux préféraient le compartiment avec nicotine. Sous lumière violette par contre, les souris passaient autant de temps dans chaque compartiment ; prouvant qu’elles n’étaient alors plus attirées par la nicotine.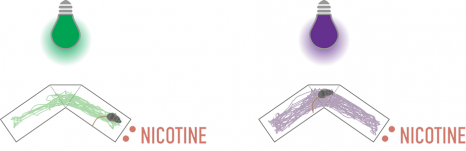
Crédits : A.Mourot/S.Mondoloni/R.Durand de Cuttoli
Cette étude démontre qu’il est possible de manipuler l’attrait pour la nicotine chez la souris, et ce de manière rapide et réversible. Alexandre Mourot, chercheur Inserm en charge de l’étude précise : « Cette technologie novatrice permet de mieux comprendre le rôle des différents récepteurs nicotiniques et des différentes voies neuronales dans la mise en place, le maintien de l’addiction à la nicotine, mais aussi dans les processus de manque et de rechute. Cette étape est particulièrement importante pour l’identification de nouvelles cibles thérapeutiques adéquates pour lutter contre l’addiction à la nicotine ».