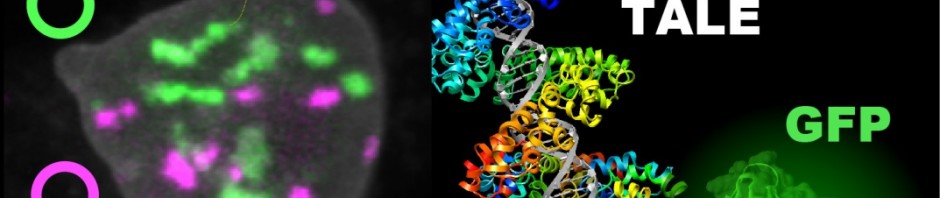
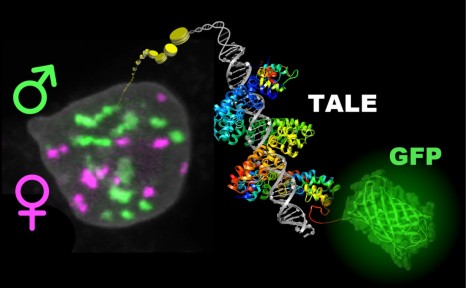
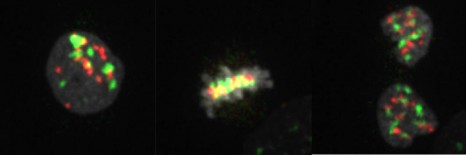
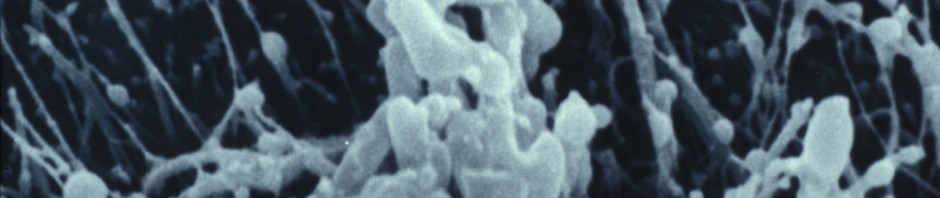
crédit photo : © Inserm/ E. Puchelle
La mucoviscidose est une maladie génétique létale qui touche en France 1 enfant pour 4500 naissances. Une équipe internationale menée par des chercheurs de l’Institut fédératif de recherche Necker-Enfants malades (CNRS/Inserm/Université Paris Descartes)1, sous la direction d’Aleksander Edelman, vient de découvrir deux nouvelles molécules qui pourraient traiter les patients porteurs de la mutation la plus fréquente. À l’aide d’un criblage virtuel et d’expérimentations sur des souris et des cellules humaines en culture, les chercheurs ont pu sélectionner, parmi 200 000 molécules, deux composés permettant à la protéine mutée responsable de la maladie de se déployer et de remplir sa fonction. Ces résultats ont été récemment publiés en ligne dans la revue EMBO Molecular Medicine.
La mucoviscidose est une maladie génétique qui touche les épithéliums2 de nombreux organes, en particulier ceux des poumons, du pancréas et de l’intestin. Dans les poumons, elle se manifeste par une hydratation insuffisante de l’épithélium qui débouche sur une surabondance de mucus dans les bronches. Ce mucus retient les agents pathogènes et favorise des infections et des inflammations chroniques qui finissent par être mortelles pour les personnes atteintes.
La maladie est causée par des mutations dans le gène codant pour une protéine appelée CFTR (cystic fibrosis transmembrane conductance regulator). Cette protéine, essentielle pour le passage de l’eau à travers les épithéliums, est un canal ionique qui permet le passage d’ions chlorure à travers la membrane des cellules. Actuellement, environ 2000 mutations du gène conduisant à la maladie sont connues. Néanmoins, 70% des cas de mucoviscidose sont dus à une seule mutation appelée ΔF508. C’est cette mutation que ciblent les molécules qui viennent d’être découvertes.
Les chercheurs ont réalisé un criblage informatique sur 200 000 molécules, recherchant celles qui pourraient interagir avec une zone spécifique de la protéine anormale. Ils ont ainsi trouvé une douzaine de molécules potentiellement actives. Avec ces 12 molécules, ils ont réalisé des tests in-vitro sur des cultures de cellules humaines, et in-vivo sur des souris présentant cette mutation. Ils ont ainsi observé que deux de ces molécules permettent à la protéine mutée ΔF508-CFTR d’être acheminée à la membrane et de remplir son rôle.
Point fort de ce travail, les chercheurs ont décrit le mécanisme d’action de ces deux molécules. En soi, la protéine ΔF508-CFTR, malgré sa mutation, pourrait remplir de façon satisfaisante sa fonction. Le problème est qu’une fois synthétisée, elle est reconnue comme anormale par une autre protéine, la kératine 8, qui favorise sa dégradation. Ainsi, ΔF508-CFTR n’atteint pas la membrane cellulaire. Les molécules découvertes par les chercheurs font obstacle à l’interaction entre la kératine 8 et ΔF508-CFTR. Ainsi, la protéine peut se déployer convenablement et remplir son rôle de canal ionique. Les chercheurs pensent que, dans le cadre d’un éventuel traitement, les deux composés découverts pourraient être associés à des molécules « potentiatrices », qui permettent d’augmenter l’activité de ΔF508-CFTR.
À présent, les chercheurs veulent savoir si, chez les souris modèles de la mucoviscidose, ces deux molécules permettent effectivement de diminuer leur susceptibilité aux infections. Dans les années à venir, ils espèrent aussi commencer les tests cliniques sur des personnes malades.
Ces recherches sont soutenues par divers contrats, notamment européens3, et les associations « Vaincre la Mucoviscidose », « Mucoviscidose : ABCF » et « Mucovie ».
(1) Travaux de recherche menés par des chercheurs du Centre de recherche croissance et signalisation, équipe Canalopathies épithéliales : mucoviscidose et autres maladies, de l’Institut fédératif de recherche Necker-Enfants malades (CNRS/Inserm/Université Paris Descartes), en collaboration avec des chercheurs de l’Institut de physiologie et biologie cellulaires (CNRS/Université de Poitiers) ; du Department of Bioinformatics, Institute of Biochemistry and Biophysics, Polish Academy of Sciences, (Warszawa, Poland) ; du Department of Molecular Genetics, German Cancer Research Center, (Heidelberg, Germany) ; du Laboratory of Plant Molecular Biology, Faculty of Biology, Warsaw University (Warszawa, Poland) ; du Department of Physiology, McGill University (Montreal, Canada) ; de la Sociéte Epithelix (Genève, Suisse).
(2) L’épithélium est un ensemble de cellules jointes entre elles (tissu) qui fait la séparation entre l’intérieur et l’extérieur de l’organisme.
(3) Contrats européens FP6 : NEUPROCF, contrats ANR : EICO-CF et CORCF (à partir de 2014) ; Legs Poix-Université Paris Descartes.