©Adobestock
Pour éditer le génome de façon précise, les chercheurs disposent désormais des « ciseaux génétiques » CRISPR/Cas9, outil très prometteur pour la thérapie génique. Le défi technologique aujourd’hui est d’amener cet outil jusqu’au génome de certaines cellules. Dans cet objectif, une équipe associant l’Inserm, le CNRS, l’Université Claude Bernard Lyon 1 et l’École normale supérieure de Lyon au sein du Centre international de recherche en infectiologie (CIRI) ont développé des capsules permettant d’amener CRISPR/Cas9 jusqu’à l’ADN cible : les Nanoblades. Décrites dans Nature Communications, elles ouvrent des perspectives pour la recherche sur l’édition du génome des cellules souches humaines.
Depuis 2012, la communauté scientifique dispose d’une méthode révolutionnaire pour « opérer » le génome de façon précise : le système CRISPR/Cas9. Ces ciseaux moléculaires sont capables de couper l’ADN à un endroit précis dans une grande variété de cellules. Ils offrent par conséquent des perspectives considérables pour la recherche et pour la santé humaine. Cependant, amener ces « ciseaux génétiques » jusqu’à leur cible – notamment le génome de certaines cellules souches – reste un défi technique.
C’est sur cette problématique que travaillent des équipes de recherche de l’Inserm, du CNRS, de l’Université Claude Bernard Lyon 1 et de l’École normale supérieure de Lyon qui ont développé les Nanoblades[1], des particules qui permettent de délivrer CRISPR/Cas9 dans de nombreuses cellules, y compris des cellules humaines.
Les scientifiques ont eu l’idée d’encapsuler le système CRISPR/Cas9 dans des structures ressemblant beaucoup à des virus et assurer ainsi sa livraison au sein d’une cellule cible, en fusionnant avec la membrane de cette dernière.
Pour concevoir ces Nanoblades, les chercheurs ont exploité les propriétés de la protéine rétrovirale GAG, qui a la capacité de produire des particules virales non infectieuses car dénuées de génome. L’équipe de recherche a fusionné la protéine GAG d’un rétrovirus de souris avec la protéine CAS9 – le ciseau du système CRISPR. Cette nouvelle protéine dite « fusion » fait l’originalité des Nanoblades.
Par conséquent, et à l’inverse des techniques classiquement utilisées pour modifier le génome, les Nanoblades encapsulent un complexe CRISPR/Cas9 immédiatement fonctionnel ; elles ne délivrent donc aucun acide nucléique codant le système CRISPR/Cas9 dans les cellules traitées. « L’action de CRISPR/Cas9 dans les cellules est ainsi temporaire. Elle est également plus précise et préserve les régions non ciblées du génome, atout particulièrement important dans le cadre d’applications thérapeutiques », précisent les auteurs.
Enfin, les chercheurs ont utilisé une combinaison originale de deux protéines d’enveloppe virales à la surface des Nanoblades pour leur permettre d’entrer dans une large gamme de cellules cibles.

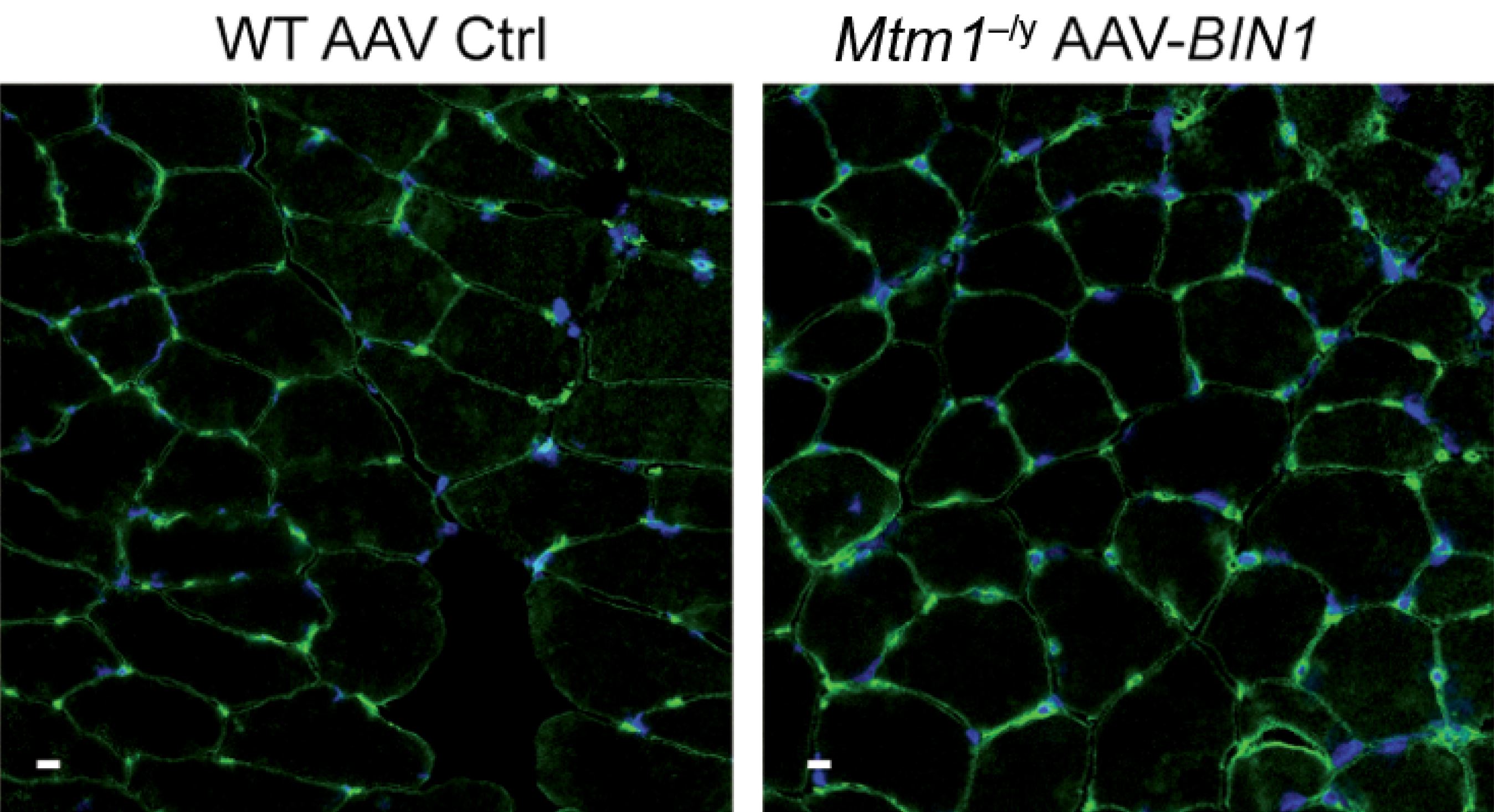
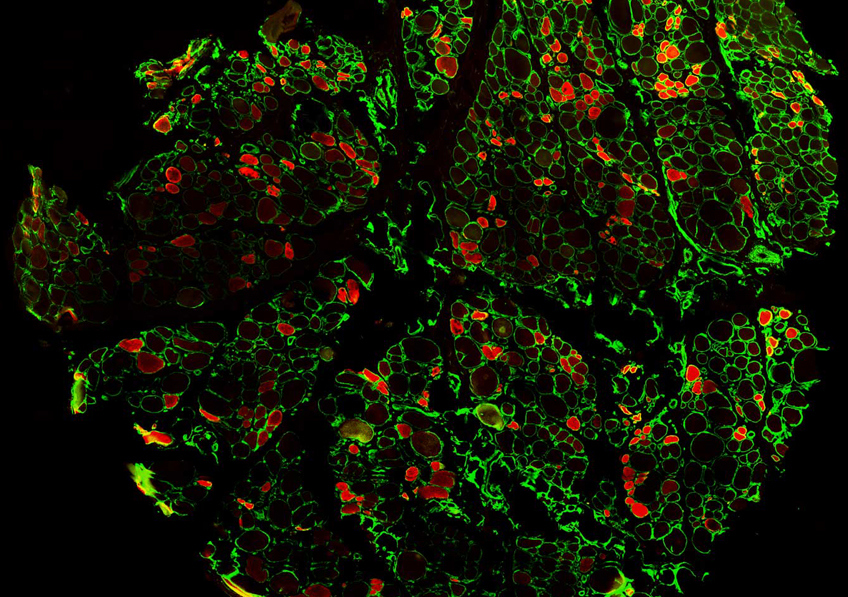
Les scientifiques ont démontré l’efficacité des Nanoblades in vivo, dans l’embryon de souris, pour un large spectre d’applications et dans un large panel de cellules cibles où d’autres méthodes sont peu performantes. « Les Nanoblades s’avèrent notamment efficaces pour corriger le génome des cellules souches humaines, cellules d’un grand intérêt thérapeutique (notamment dans la reconstitution de tissus) mais restant difficiles à manipuler par les méthodes habituelles », précisent les auteurs de ces travaux.
[1] Les Nanoblades ont été testées chez la souris et brevetées en 2016 par Inserm Transfert.