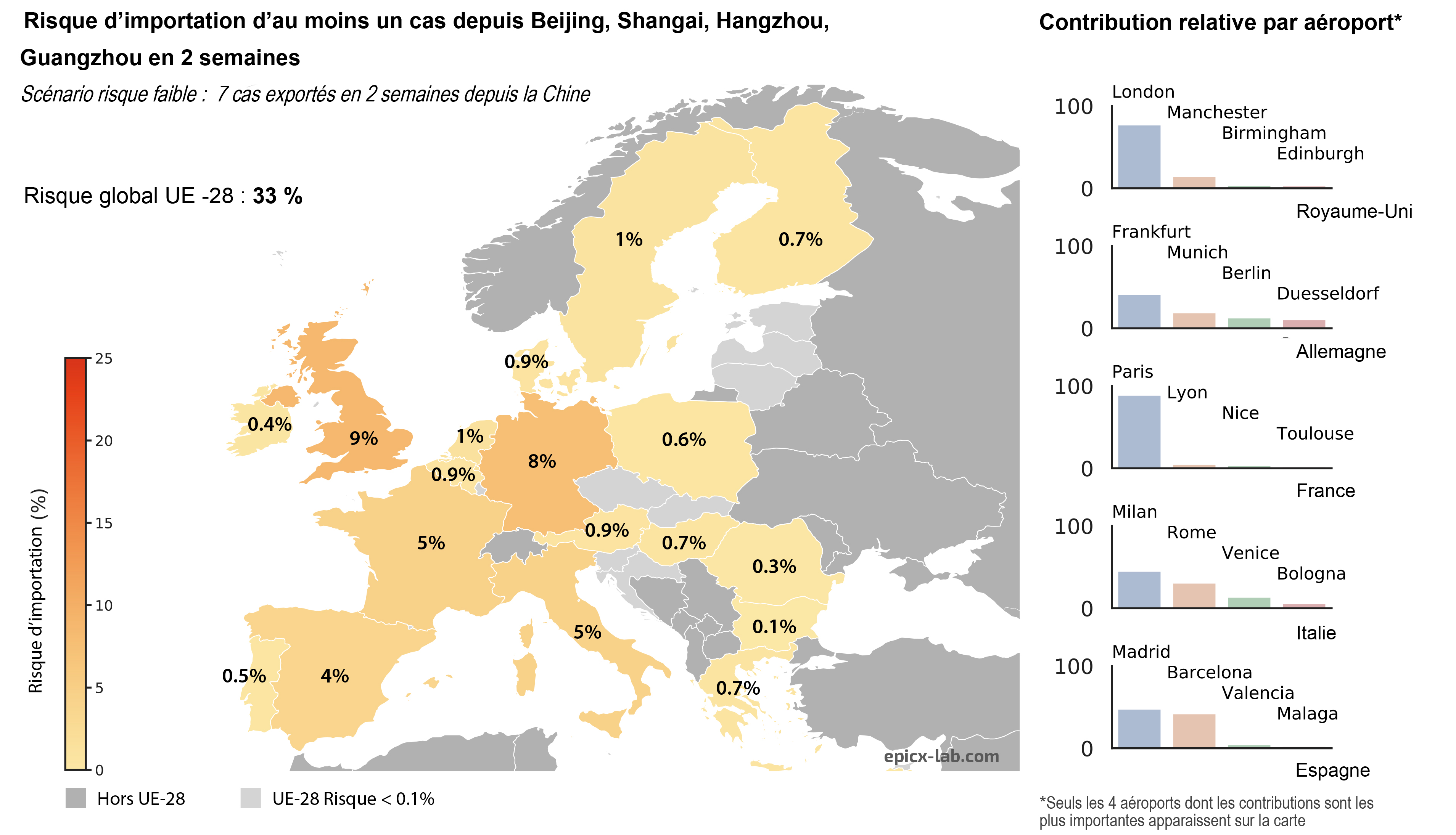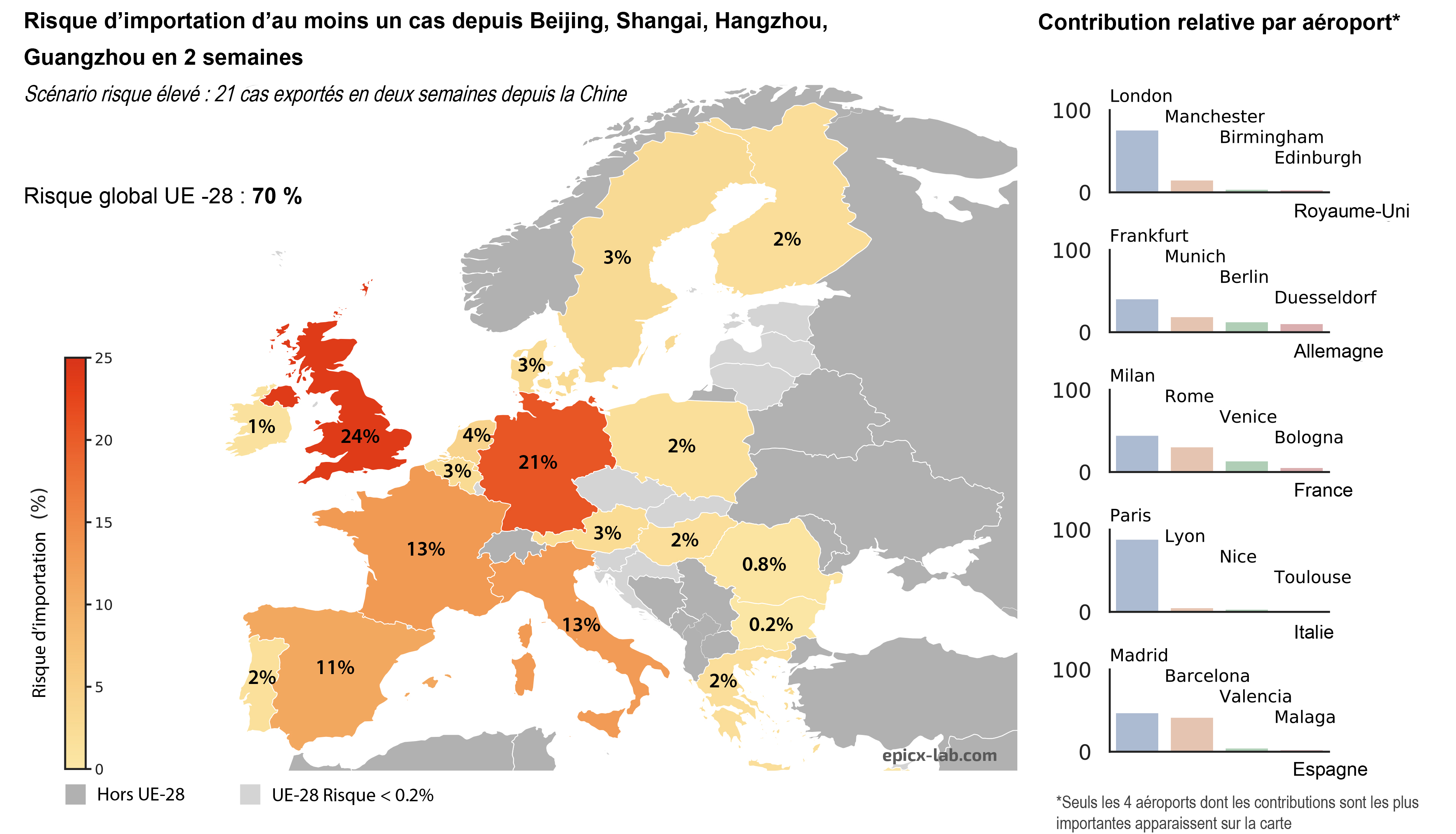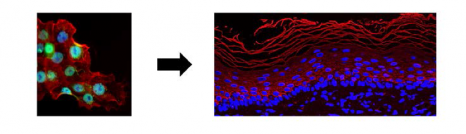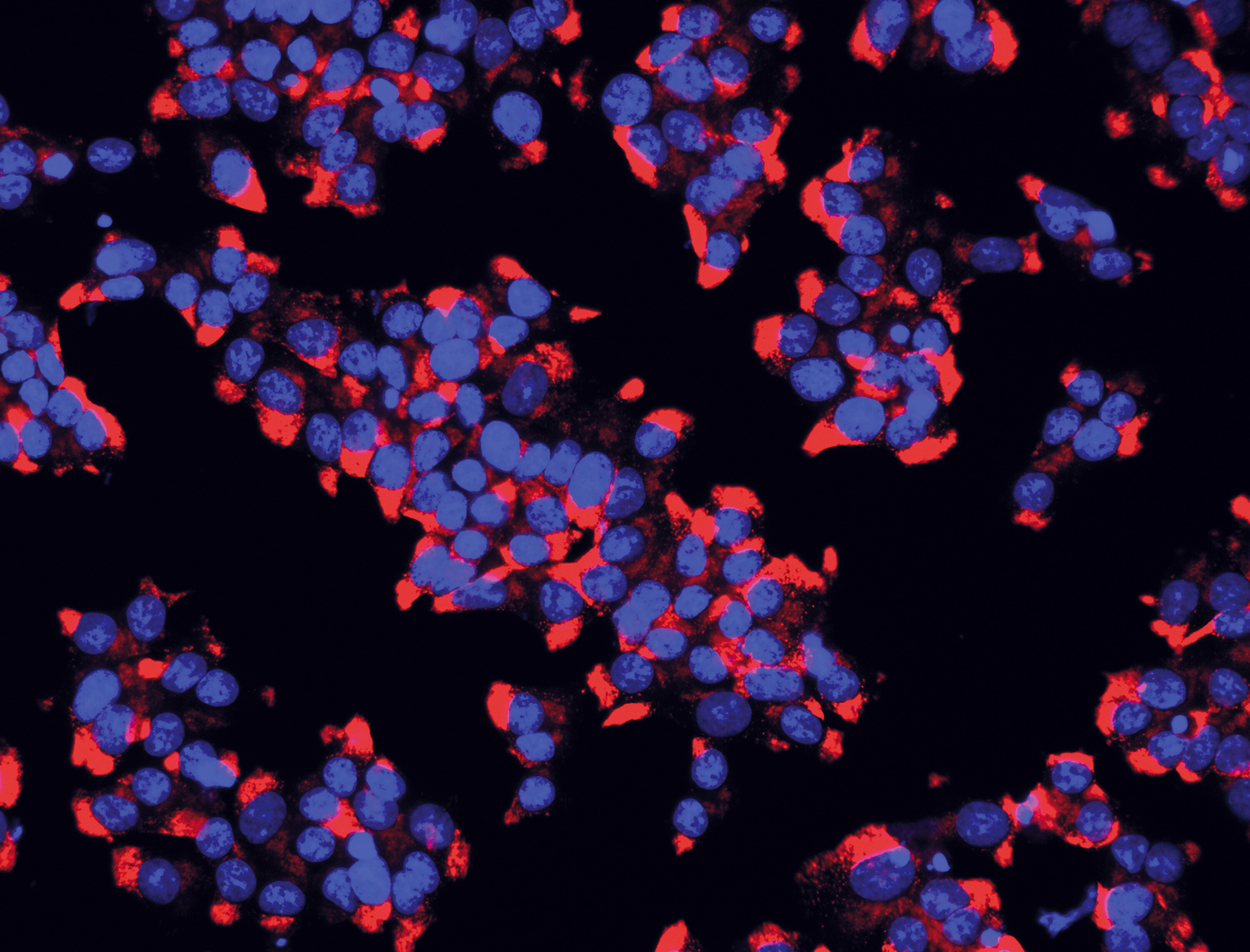
Les cellules bêta des îlots de Langerhans du pancréas sont celles qui produisent l’insuline. Ici, les noyaux sont colorés en bleu et l’insuline contenue dans les cellules ß est visualisée en rouge. © Inserm/U845/UMRS975/EndoCells SARL
Un composé organique produit par la flore intestinale, le métabolite 4-Cresol, aurait des effets protecteurs contre le diabète de type 1 et de type 2, notamment en stimulant la croissance des cellules bêta du pancréas qui produisent l’insuline. C’est ce que montre une nouvelle étude, dirigée par le chercheur Inserm Dominique Gauguier au sein du laboratoire « Toxicité environnementale, cibles thérapeutiques, signalisation cellulaire et biomarqueurs » (Inserm/Université de Paris) et publiée dans le journal Cell Reports. Ces résultats ouvrent la voie à de nouvelles pistes thérapeutiques qui pourraient améliorer la situation de millions de patients.
Plus de trois millions de Français sont atteints de diabète, tous types confondus. Cette maladie, dont la prévalence ne cesse d’augmenter, est associée à un risque accru de développer des pathologies cardiovasculaires, ce qui en fait un problème de santé publique majeur. Développer et améliorer les traitements destinés à ces patients est donc essentiel.
Des études récentes ont montré que les formes fréquentes de diabète sont causées par la mutation de plusieurs gènes et par des facteurs liés à l’environnement et à certaines compositions de la flore intestinale.
Des travaux menés par le chercheur Inserm Dominique Gauguier au sein du laboratoire « Toxicité environnementale, cibles thérapeutiques, signalisation cellulaire et biomarqueurs » (Inserm/Université de Paris), en collaboration avec des collègues de l’Université de Kyoto (Japon) et de l’Université de McGill (Canada), viennent renforcer ces résultats. Ces travaux mettent en effet à jour une association entre le diabète et un composé organique produit par la flore intestinale et également présent dans certains aliments, le métabolite 4-cresol.
Les chercheurs ont d’abord réalisé une étude de profilage métabolique, pour identifier tous les types de métabolites présents dans l’organisme, à partir d’échantillons sanguins de 148 adultes, certains d’entre eux diabétiques. L’idée : identifier des marqueurs pouvant être associés au développement de la maladie. « Nous nous sommes aperçus que le 4-Cresol présentait un réel intérêt. Produit du métabolisme de la flore intestinale, ce composé semble être un marqueur de résistance au diabète. On retrouve notamment des quantités plus faibles de 4-Cresol dans le sérum des patients diabétiques que chez des individus non diabétiques », explique François Brial, chercheur Inserm et premier auteur de l’étude.
Travaillant à partir de modèles de diabète et d’obésité chez le rat et la souris, les chercheurs ont ensuite testé les effets du 4-Cresol sur les signes cliniques du diabète et sur le fonctionnement des cellules bêta du pancréas, qui sécrètent l’hormone insuline, dont le rôle est de maintenir l’équilibre du taux de glucose contenu dans le sang. Ces cellules bêta s’épuisent au cours de la maladie.
Pistes de traitement
L’équipe a ainsi montré qu’un traitement chronique de 4-Cresol à faible concentration conduit à une amélioration du diabète. Les chercheurs observent notamment une réduction de l’obésité et de l’accumulation de graisse dans le foie, ainsi qu’une augmentation de la masse pancréatique, une stimulation de la sécrétion d’insuline et une prolifération des cellules bêta pancréatiques.
« Alors que nous manquons aujourd’hui de thérapies pour stimuler la prolifération des cellules bêta du pancréas et améliorer leur fonction, ces résultats sont donc particulièrement encourageants. Par ailleurs, ils confirment l’impact de la flore intestinale sur la santé humaine, démontrant le rôle bénéfique d’un métabolite produit par des bactéries intestinales, et ouvrant de nouvelles pistes thérapeutiques dans le diabète, l’obésité et la stéatose hépatique », souligne Dominique Gauguier.
Désormais, l’objectif immédiat des chercheurs est d’étudier les possibilités de moduler la flore intestinale pour rétablir la production du 4-cresol chez les patients diabétiques. Pour cela, ils vont d’abord tenter d’identifier les bactéries qui produisent naturellement ce métabolite, puis définir lesquelles pourraient s’avérer être des traitements potentiels, sûrs et efficaces dans des syndromes de déficit en insuline.
Sur la base d’études récentes, les patients diabétiques peuvent déjà se voir proposer de nouvelles options thérapeutiques. Des transferts de flore intestinale peuvent notamment être envisagés, même si les mécanismes d’action de ces traitements ne sont pas encore bien compris, ou encore des opérations de chirurgie bariatrique, qui restent lourdes et invasives. « Notre but est de parvenir à des pistes thérapeutiques qui permettent une modulation fine de la flore intestinale, en favorisant la prolifération de « bonnes » bactéries dont on comprend mieux le fonctionnement, et la production de 4-Cresol à des doses thérapeutiques », conclut Dominique Gauguier.