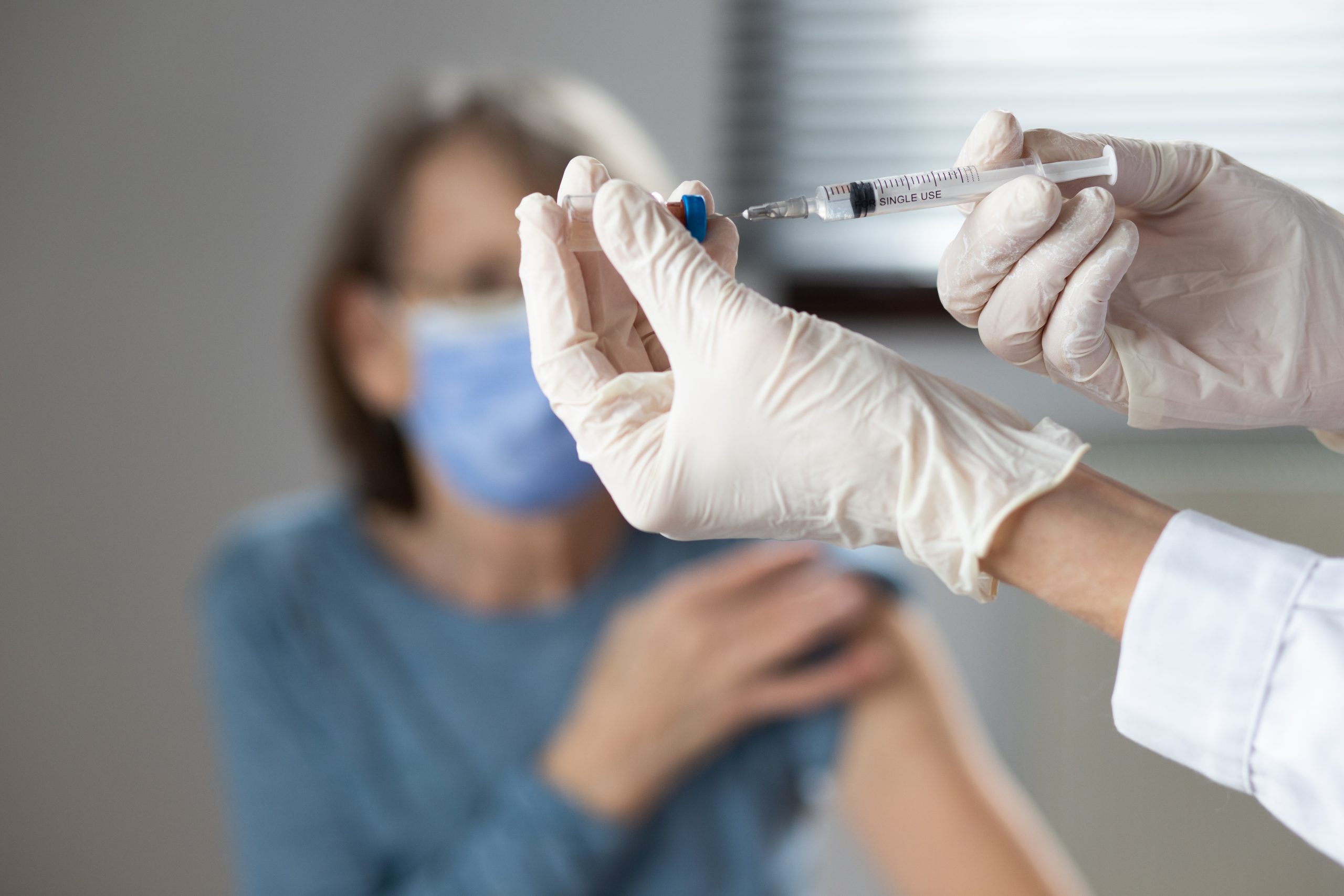
Les scientifiques réfléchissent à de nouvelles stratégies pour continuer à promouvoir la vaccination auprès des populations qui demeurent hésitantes © Mat Napo sur Unsplash
Bien que la majorité de la population française soit entièrement vaccinée, la circulation du virus est toujours active dans le pays. Dans un contexte de levée des restrictions sanitaires, la crainte d’une reprise épidémique et de l’émergence de nouveaux variants plus contagieux conduit les scientifiques à réfléchir à de nouvelles stratégies pour continuer à promouvoir la vaccination auprès des populations qui demeurent hésitantes. Une nouvelle étude de modélisation réalisée par des chercheurs et chercheuses de l’Inserm et de Sorbonne Université à l’Institut Pierre Louis d’Epidémiologie et de Santé Publique montre qu’une stratégie de vaccination dite « réactive », dans laquelle la vaccination est proposée à tout l’entourage d’une personne infectée, pourrait avoir des effets bénéfiques, réduisant le nombre de cas de Covid-19 dans certaines situations épidémiques. Les résultats de ces travaux sont publiés dans le journal Nature Communications. Les chercheurs ont été soutenus par l’ANRS | Maladies infectieuses émergentes via le projet Emergen.
Les campagnes de vaccination massive contre la Covid-19 dans de nombreux pays ont permis d’atténuer considérablement la pandémie. Toutefois, le taux de personnes vaccinées stagne désormais en Europe et aux Etats-Unis, à cause de contraintes logistiques et de l’hésitation d’une partie de la population à se faire vacciner.
En mars 2022, 79 % des Français étaient complètement vaccinés avec un schéma vaccinal à deux doses et 53 % avait reçu la troisième dose de rappel. Même si ces nombres sont élevés, les efforts pour contrer l’épidémie doivent être maintenus car dans un contexte de circulation virale toujours élevée et de levée des restrictions sanitaires, la reprise épidémique n’est pas encore exclue, et, avec elle, l’apparition de variants plus contagieux.
Dans ce contexte, de nombreux scientifiques estiment donc qu’il faut tester d’autres stratégies vaccinales favorisant accessibilité et acceptabilité pour une meilleure efficacité.
Les chercheuses et chercheurs de l’Inserm et de Sorbonne Université se sont ainsi intéressés à une stratégie de vaccination dite « réactive », qui implique de vacciner l’ensemble de l’entourage des cas dans le foyer et le lieu de travail ou de scolarité. Cette approche est déjà utilisé dans d’autres contextes épidémiques, par exemple face à des vagues de méningites. Dans le contexte de la Covid-19, elle a ponctuellement été utilisée sur le terrain en France, par exemple à Strasbourg au sein de la Haute Ecole des Arts du Rhin (HEAR), à la suite de la découverte d’un cluster du variant delta.
Qu’est-ce que la « vaccination en anneau » (ring vaccination) ?
Dans d’autres contextes épidémiques, par exemple lors de certaines épidémies d’Ebola, d’autres stratégies innovantes ont été déployées pour toucher le plus de monde possible. La plus connue est la stratégie de vaccination en anneau qui consiste à vacciner autour d’un cas avéré les cas contacts directs et les cas contacts de ces derniers.
L’équipe de recherche a voulu évaluer les effets de cette approche réactive sur la circulation virale et le nombre de cas de Covid-19, dans différents scénarios épidémiques. Pour construire leur modèle, les scientifiques se sont appuyés sur des données de l’Insee afin de modéliser une population type, possédant les caractéristiques sociodémographiques, les contacts sociaux et les situations professionnelles d’une population d’une ville française de taille moyenne.
Plusieurs paramètres ont par ailleurs été intégrés au modèle, notamment les caractéristiques de la maladie, la couverture vaccinale, l’efficacité des vaccins, les restrictions des contacts dans les lieux de travail ou dans la communié, leurs déplacements, ou encore la mise en place de stratégies de traçage des cas-contacts.
Les scientifiques ont alors pu étudier l’impact d’une stratégie de vaccination réactive dans le cadre de plusieurs scénarios de dynamique épidémique. Ils montrent ainsi que dans la plupart des scénarios, avec un même nombre de doses de vaccins, une stratégie réactive est plus efficace que d’autres stratégies de vaccination pour réduire le nombre de cas de Covid-19.
Par exemple, dans un contexte où la couverture vaccinale est d’environ 45 % et où la circulation virale est élevée, la réduction du nombre de cas sur une période de deux mois passe de 10 à 16 %, si on compare un programme de vaccination de masse avec un programme où la vaccination réactive est mise en place en parallèle à la vaccination de masse.
Les résultats suggèrent que cette stratégie est surtout efficace lorsque la couverture vaccinale est faible et lorsqu’elle est couplée à des mesures robustes de traçage des cas-contacts.
Lorsque la couverture vaccinale est élevée, une stratégie réactive est moins intéressante, puisque majorité de l’entourage de la personne infectée est déjà vaccinée. Néanmoins, une telle approche aurait quand même le bénéfice d’atteindre les personnes qui ne seraient pas encore vaccinées et de les convaincre plus facilement de l’utilité du vaccin. En effet, le fait d’avoir été exposé au virus augmente la perception des risques et tend à rendre la vaccination plus acceptable.
« Le modèle que nous avons construit permet d’envisager la vaccination réactive comme une stratégie efficace pour augmenter la couverture vaccinale et pour réduire le nombre de cas dans certains scénarios épidémiques, surtout lorsqu’elle est couplée à d’autres mesures comme un traçage efficace des cas contacts. Il s’agit d’un outil qui pourra aussi être réutilisé et adapté en France dans le cas où un autre variant émergerait et où il faudrait tester l’efficacité d’une stratégie réactive pour administrer d’éventuelles doses de rappel. Cette modélisation peut aussi intéresser d’autres pays aux caractéristiques sociodémographiques similaires à la France, dans lesquels la couverture vaccinale est plus faible », explique Chiara Poletto, chercheuse Inserm et dernière auteure de l’étude.