Un nouveau mécanisme de défense naturelle contre les infections vient d’être mis en évidence par une équipe internationale menée par des chercheurs du CNRS, de l’Inserm, de l’Institut Pasteur et de l’Université Paul Sabatier – Toulouse III (1). Le zinc, métal lourd toxique à forte dose, est utilisé par les cellules du système immunitaire pour éliminer les microbes tels que le bacille de la tuberculose ou E. coli.Publiée dans la revue Cell Host & Microbe le 14 septembre 2011, cette découverte permet d’envisager de nouvelles stratégies thérapeutiques et de tester de nouveaux candidats-vaccins.
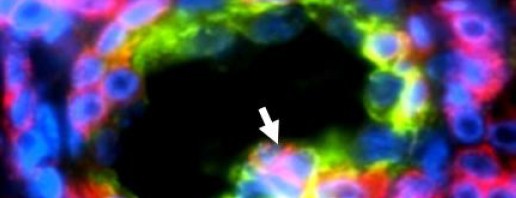
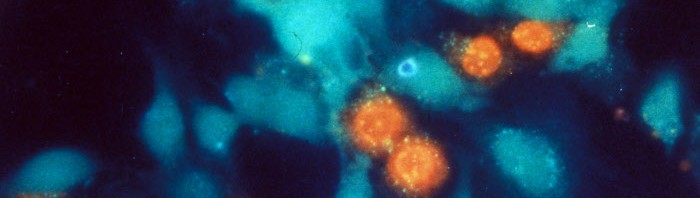
L’une des stratégies bien connues de notre système immunitaire pour détruire les microbes consiste à les priver de nutriments essentiels comme les métaux lourds, notamment le fer. Pour la première fois, une étude internationale menée par les chercheurs de l’Institut de pharmacologie et de biologie structurale (CNRS/Université Paul Sabatier – Toulouse III), du Centre d’immunologie de Marseille Luminy (CNRS/Inserm/Université de la Méditerranée) et de l’Institut Pasteur, révèle que l’inverse est également vrai : les cellules immunitaires sont capables de mobiliser des réserves de métaux lourds, en particulier de zinc, pour intoxiquer les microbes. Ce phénomène vient d’être mis en évidence pour Mycobacterium tuberculosis, l’agent de la tuberculose chez l’homme qui fait près de 2 millions de morts par an dans le monde ainsi que pour Escherichia coli dont certaines souches sont responsables d’infections graves du système digestif et urinaire. Dans les cellules du système immunitaire (les macrophages -2) ayant ingéré M. tuberculosis ou E. coli, les chercheurs ont constaté une accumulation rapide et persistante de zinc. Ils ont également observé la production de nombreuses protéines à la surface des microbes dont la fonction est de « pomper », c’est-à-dire d’éliminer les métaux lourds à l’extérieur de ces organismes. Dans les macrophages, les microbes sont donc exposés à des quantités potentiellement toxiques de zinc et ils tentent de se protéger contre une intoxication en
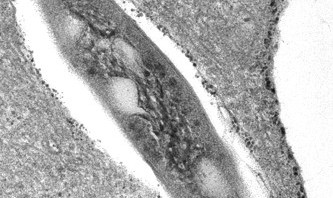
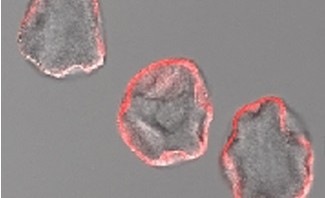
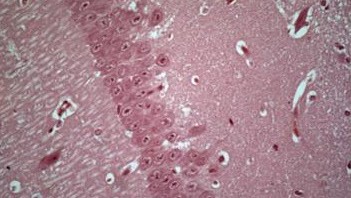
© Chantal de Chastellier
Cette figure représente un bacille tuberculeux (M. tuberculosis) dans un macrophage. Le compartiment dans lequel réside le bacille (vacuole appelée phagosome) est riche en zinc, que l’on voit sous forme de petits dépôts noirs (sulfate de zinc) en microscopie électronique après traitement spécifique.
synthétisant ces pompes. Preuve en est qu’en inactivant par génie génétique ces pompes, M. tuberculosis et E. coli deviennent encore plus sensibles à la destruction par les macrophages.
Le zinc, bien que toxique quand il est ingéré en trop grande quantité, est donc bénéfique pour le système immunitaire, en particulier parce qu’il est utilisé par les macrophages pour intoxiquer les microbes. Des mécanismes équivalents pourraient exister pour d’autres métaux lourds comme le cuivre. Ces résultats ont des implications cliniques très concrètes. Ils permettent notamment de reposer la question de la complémentation nutritionnelle dans le traitement des malades (ex. par le zinc). Ils pourraient aussi être à l’origine de nouveaux antibiotiques qui bloqueraient l’action des pompes microbiennes à métaux ou de nouvelles souches vaccinales atténuées qui sont actuellement déjà testées comme candidats vaccins.
Note
(1) Ces chercheurs travaillent à l’Institut de pharmacologie et de biologie structurale (CNRS/Université Paul Sabatier – Toulouse III), au Centre d’immunologie de Marseille Luminy (CNRS/Inserm/Université de la Méditerranée) et au sein de l’Unité de génétique mycobactérienne de l’Institut Pasteur.
(2) Un macrophage est une cellule du système immunitaire. Il est localisé dans les tissus pouvant être soumis à des infections ou à une accumulation de débris à éliminer (foie, poumons, ganglions lymphatiques, rate…) et possède notamment une fonction de phagocytose, à savoir la capacité d’ingérer des bactéries, levures, débris cellulaires… (la vésicule intracellulaire formée lors de la phagocytose est appelée phagosome et sera dirigée vers le lysosome pour sa dégradation complète).