À l’occasion de la journée mondiale contre le cancer, l’Association pour la Recherche sur le Cancer (ARC) l’Inserm et l’Institut national de cancer (INCa) présentent un web documentaire intitulé « Recherche sur les cancers : tout s’accélère ». Il sera disponible sur leurs trois sites internet et sur www.recherche-tout-saccelere.fr dès le 4 février 2012. Cet outil multimédia interactif met en lumière les axes de recherche actuels les plus prometteurs, avec pour fil rouge les avancées concourant au développement d’une approche individualisée du traitement des cancers. Outil grand public à vocation pédagogique, il présente l’originalité de mettre en lien le travail des chercheurs et la réalité du cancer telle qu’elle est vécue par les malades.
L’interface du web documentaire est construite à partir de témoignages d’anciens malades, points d’entrée des chapitres, vers des interviews de chercheurs et de médecins, illustrées de reportages sur leurs lieux de travail. L’ensemble est organisé en quatre parties correspondant aux champs d’application majeurs de la recherche : comprendre, soigner, accompagner et enfin, prévenir et détecter. L’objectif : incarner de façon tangible, pour un public non spécialiste, les progrès à l’oeuvre aujourd’hui et envisageables demain, et contribuer ainsi à modifier l’image de la maladie.
Le cancer, enjeu majeur de santé publique, fait en effet partie de nos vies. On estime à 365 500 le nombre de nouvelles personnes touchées en France en 2011. Mais aujourd’hui aussi, plus d’une personne sur deux guérit de sa maladie. Et plus de 3 300 chercheurs et techniciens travaillent quotidiennement sur les différents aspects de la recherche au service d’avancées se traduisant notamment par un accès de plus en plus rapide à des traitements de plus en plus individualisés.
Une accélération dans la compréhension de la maladie
Il y a 40 ans, on découvrait que les cellules cancéreuses présentent des anomalies de leurs gènes, le plus souvent survenues au cours de la vie de l’individu. Restaient à décrypter ces anomalies. Si le séquençage du génome humain dans les années 2000 a nécessité une dizaine d’années, aujourd’hui, grâce aux progrès techniques, il ne faut pas plus de quelques jours pour séquencer le génome d’une tumeur. Les chercheurs sont unanimes : la recherche en cancérologie a fait des bonds de géant ces dernières années et continue de s’accélérer.
Un progrès majeur : les thérapies ciblées
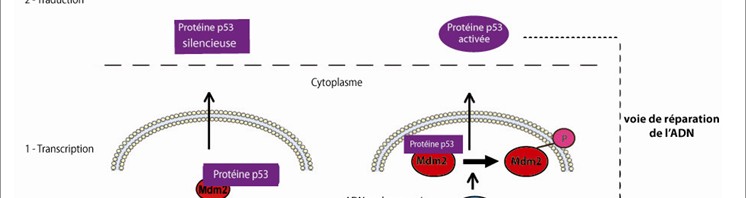
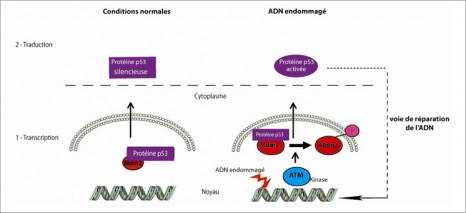
Des anomalies génétiques identiques peuvent être retrouvées dans les cellules cancéreuses de patients dont les cancers touchent des organes différents. À l’opposé, les altérations peuvent être très différentes chez des patients atteints d’un même cancer. Ces anomalies qui peuvent souvent être détectées par des tests biologiques deviennent des cibles potentielles pour les traitements médicamenteux : on parle alors de thérapies ciblées.
Aujourd’hui en France, 28 laboratoires régionaux proposent pour l’ensemble des patients qui le nécessitent des tests permettant d’adapter leurs traitements aux caractéristiques des tumeurs. Les thérapies ciblées sont utilisées dans plusieurs types de cancers principalement dans le cancer du sein, le cancer du poumon et le cancer colorectal, et dans certaines leucémies et cancers rares. Véritables illustrations des bénéfices de la recherche, les thérapies ciblées constituent ainsi des traitements « sur mesure » adaptés aux caractéristiques de la tumeur des patients.
L’accompagnement des personnes
Une personne malade est une personne qu’il faut accompagner, dans son parcours de soin, à l’hôpital, lors de son retour à la maison et tout au long de sa réinsertion professionnelle. Les chercheurs en sciences sociales s’intéressent ainsi à la qualité de vie sociale et psychique des personnes touchées par la maladie et de leurs proches. Surmonter la détresse, apprivoiser la maladie et ensuite reprendre le cours de la vie sont des étapes importantes du parcours de la personne malade. La recherche s’intéresse à ces différentes étapes ainsi qu’à la place du malade et à l’image de la maladie dans notre société pour apporter aux professionnels des éléments de compréhension et favoriser un meilleur accompagnement.
Des progrès dans la prévention et la détection
En amont de la maladie, la recherche s’intéresse aussi à la façon de mieux cerner et comprendre les facteurs de risque de cancer, de mieux informer la population pour inviter à des changements de comportements individuels plus favorables à la santé (arrêt du tabac, baisse de la consommation d’alcool, pratique de l’activité physique et équilibre de l’alimentation, limitation des expositions solaires…) Elle s’intéresse aussi aux modes de détection des cancers permettant un diagnostic précoce et donc une prise en charge plus efficace.
Une mutualisation des efforts
Si la recherche progresse, c’est également parce que les équipes mutualisent leurs moyens pour parvenir à des résultats rapides et probants. Depuis plusieurs années, une meilleure coordination et structuration de la recherche entre les différents acteurs, publics et privés, institutionnels et associatifs, concourt à une performance nouvelle. De nombreux partenariats rendent ainsi possible l’accès des innovations thérapeutiques de très haut niveau technique au plus grand nombre. Cette priorité des chercheurs est fortement soutenue par la volonté des pouvoirs publics exprimée dans le Plan cancer 2009-2013.
« On compte environ 365 000 nouveaux cas de cancers chaque année en France.
Aujourd’hui, plus d’un sur deux est guéri, en grande partie grâce aux efforts des chercheurs et des médecins. Quelle que soit leur discipline d’origine, ces scientifiques poursuivent un même but : proposer une médecine de plus en plus personnalisée et efficace contre la maladie.
Alors qu’une nouvelle ère dans la lutte contre les cancers débute, nous avons poussé la porte des laboratoires où s’élaborent les traitements de demain. »
www.recherche-tout-saccelere.fr
Réalisation et production exécutive : CAPA Entreprises
Direction artistique et coordination : agence La Chose
Développement : Lumini
En partenariat avec : Dailymotion