©Flore Avram/Inserm
Une quinzaine de scientifiques sous la direction de Samuel Vergès, chercheur Inserm au sein du laboratoire « Hypoxie et physiopathologies cardiovasculaire et respiratoire » (Inserm/Université Grenoble Alpes), vont mener une expédition scientifique sur l’effet du manque d’oxygène sur la santé. Début 2019, ils se rendront pendant 6 semaines dans la ville la plus haute du monde, à 5 300 m, au Pérou, pour étudier les adaptations physiologiques de ses habitants à des conditions de vies extrêmes mais aussi analyser leurs problèmes de santé spécifiques liés à l’altitude. À terme, les chercheurs souhaitent utiliser ces données pour mieux comprendre et traiter des pathologies liées au manque d’oxygène.
Comprendre comment l’organisme humain peut s’adapter au manque d’oxygène, déterminer pourquoi certaines personnes n’arrivent pas à développer de tels mécanismes, identifier des moyens d’aider à mieux tolérer le manque d’oxygène sont autant d’enjeux essentiels tant pour les personnes se rendant ou résidant en haute altitude que pour le traitement de nombreuses maladies dans des environnements moins extrêmes.
Située au Pérou à 5 300 m d’altitude, à la frontière avec la Bolivie, La Rinconada est une ville dont l’activité économique principale est liée à l’exploitation d’une mine d’or. Les employés de cette mine et leur famille y vivent dans des conditions extrêmes non seulement du fait de l’altitude (plus élevée que celle du Mont-Blanc) mais aussi de l’impossibilité d’acheminer des services tels que l’électricité ou l’eau courante.
L’altitude représente un environnement extrême mettant en valeur les capacités et les limites d’adaptation de l’organisme humain. La diminution de la quantité d’oxygène disponible en altitude (l’hypoxie) fait de cet environnement un véritable laboratoire à ciel ouvert. C’est pourquoi La Rinconada a retenu l’attention des scientifiques grenoblois.
Les objectifs scientifiques de la mission
Les chercheurs de l’unité 1042 de l’Inserm, spécialisés dans la recherche sur l’altitude et l’hypoxie, travailleront de concert avec d’autres équipes internationales pour mettre en place en février 2019 un laboratoire éphémère de physiologie et biologie humaines au cœur de la ville de La Rinconada. Afin de mieux soigner les conséquences physiopathologiques et les maladies liées au manque d’oxygène, ils souhaitent faire avancer la recherche dans différents domaines.
Améliorer les soins
Lorsqu’une personne résidant habituellement en plaine se rend en altitude, trois phénomènes majeurs et délétères pour la santé peuvent apparaître :
– le mal aigu des montagnes, un syndrome qui associe maux de tête, nausées, fatigue, trouble du sommeil et dont souffre la moitié des personnes qui montent à plus de 4 000 m d’altitude ;
– l’œdème pulmonaire de haute altitude ;
– l’œdème cérébral de haute altitude ;
Ces deux derniers phénomènes sont beaucoup plus graves et peuvent être fatals. Aujourd’hui, seul l’apport d’oxygène par des bouteilles ou la ré-oxygénation par le biais d’un caisson hyperbare peuvent y remédier. Pour y faire face, Il se pourrait que les habitants de La Rinconada aient pu au cours du temps développer des adaptations génétiques à la vie en altitude. Il semble cependant qu’ils soient aussi touchés de façon fréquente par un autre type de pathologie : le syndrome de mal chronique des montagnes, qui concerne les personnes résidant en permanence en altitude.
Comprendre les mécanismes d’adaptation à l’hypoxie d’altitude est la priorité des chercheurs pour soigner les patients souffrant du manque d’oxygène à La Rinconada mais également pour soigner des pathologies plus courantes en plaine. Des pathologies comme la bronchopneumopathie chronique obstructive, l’apnée du sommeil ou la drépanocytose se caractérisent en effet par une exposition du malade à des conditions d’oxygénation insuffisante du fait d’anomalies respiratoires ou hématologiques. Comprendre comment l’organisme humain peut tolérer plus ou moins difficilement l’hypoxie pourrait permettre d’individualiser les soins et d’affiner les prises en charge thérapeutiques.
Faire progresser la technologie
L’unité 1042 développe certains outils diagnostiques ou de prise en charge thérapeutique s’appliquant aux conditions de moindre oxygénation, que ce soit en altitude ou chez le malade respiratoire par exemple. Lors d’une expédition antérieure dans l’Himalaya, l’équipe du Dr Vergès a ainsi mis au point un masque d’altitude visant à améliorer la diffusion de l’oxygène à travers les poumons. Ce masque est sur le point d’être commercialisé auprès des personnes vivant en plaine et se rendant an altitude
Transposer à la vie dans l’espace
Une fois quitté l’environnement terrestre, il est très difficile de reproduire des conditions identiques à la vie sur Terre en termes de disponibilité en oxygène. Ceci signifie que les futurs voyageurs et habitants spatiaux devront être capables de vivre en permanence dans des conditions d’oxygénation équivalentes à la haute altitude et donc de développer des mécanismes d’adaptation à l’hypoxie dont les populations de haute altitude sur Terre sont devenues expertes au fil des générations. Comprendre ces mécanismes d’adaptation, leurs intérêts et leurs limites permet ainsi de mieux concevoir l’adaptation des hommes à une vie en dehors de l’atmosphère terrestre.
Près de 20 experts scientifiques et médicaux européens et péruviens seront présents lors de cette expédition.
Le déroulement de l’expédition

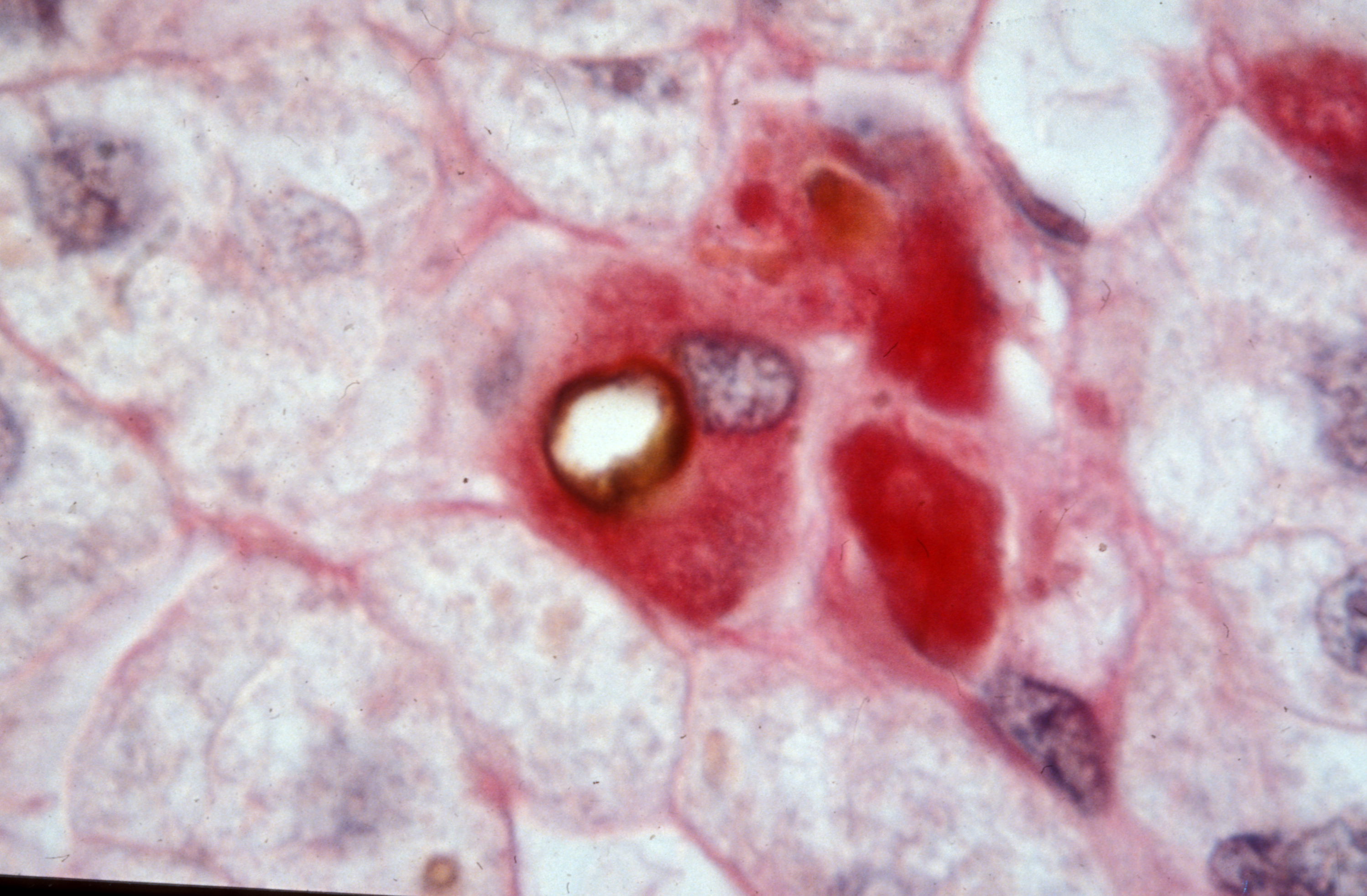
Un premier repérage de 10 jours début octobre au Pérou a permis à l’équipe de chercheurs de mettre en place les aspects logistiques particulièrement exigeants d’une telle expédition, d’établir les relations nécessaires avec les acteurs sur place ainsi que d’étudier avec Ivan Hancco, médecin péruvien à La Rinconada, les données préliminaires collectées ces derniers mois auprès des habitants de la ville. Ces données ont indiqué des niveaux très élevés par rapport à d’autres populations d’altitude du syndrome de mal chronique des montagnes. Des particularités sanguines traduisant des réponses physiologiques extrêmes à l’hypoxie ont été relevées également.
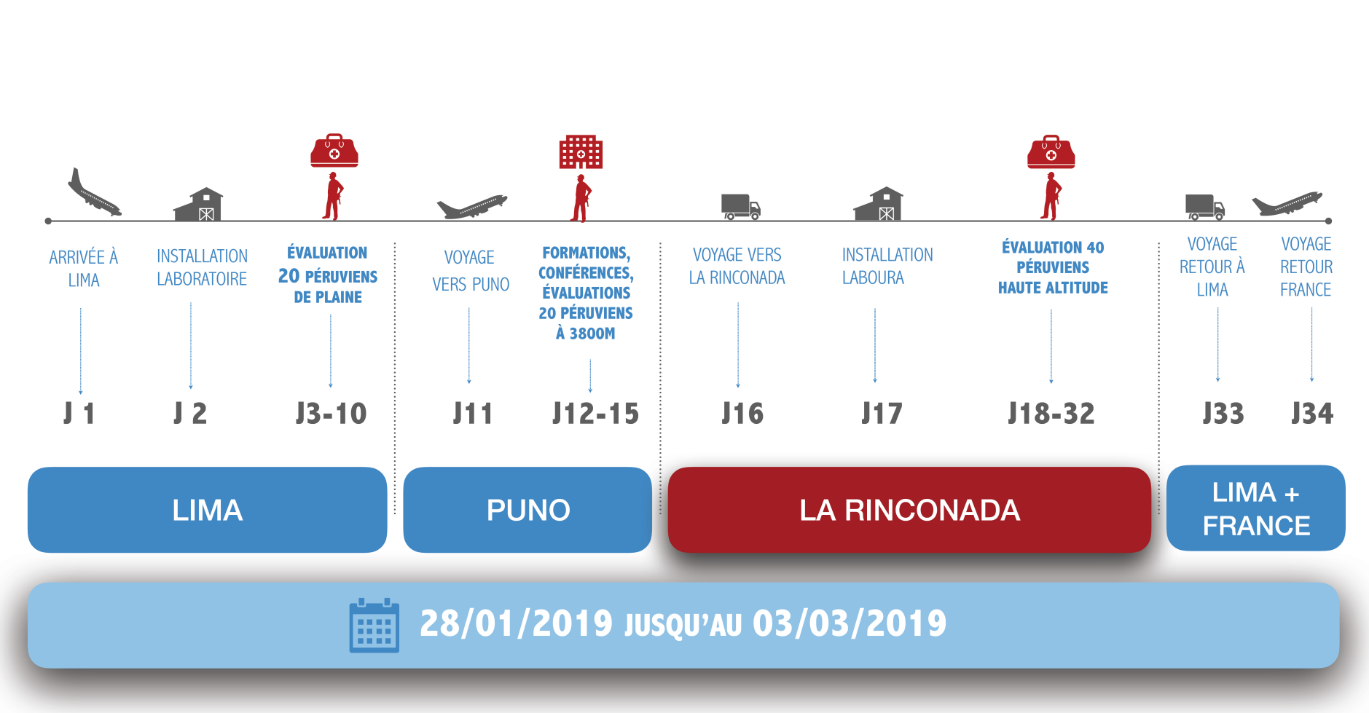
À partir de février 2019, 40 habitants de La Rinconada vont être scannés de la tête aux pieds par les scientifiques. Les participants volontaires seront séparés en deux groupes, l’un présentant une bonne santé et donc une bonne tolérance à l’hypoxie d’altitude, l’autre présentant des symptômes d’intolérance (céphalées, vertiges, palpitations, cyanose, varices…) et probablement des pathologies sous-jacentes spécifiques encore à élucider. Deux groupes supplémentaires de 20 Péruviens habitants à Lima et, à moindre altitude, à Puno (3 800 m) seront également évalués de façon identique aux habitants de La Rinconada, afin de pouvoir comparer leurs caractéristiques.
Pendant 30 jours, les chercheurs vont étudier le profil génétique des participants, la qualité de leur sommeil, leurs capacités à l’effort physique, et récolter des analyses concernant leurs caractéristiques sanguines, cardiovasculaires et cérébrales.
Concrètement, un laboratoire scientifique et médical sera installé sur place pendant 6 semaines. Plusieurs centaines de kilos de matériel spécialisé seront ainsi transportés par avion et véhicules tous terrains sur les 3 lieux des évaluations au Pérou (Lima, Puno et La Rinconada). L’équipe de chercheurs étudiera 6 à 8 volontaires par jour, chacun ayant à passer deux journées auprès de l’équipe pour réaliser l’ensemble des évaluations. Les personnes seront également étudiées pendant leur sommeil et devront porter des capteurs pendant 24 heures. Certains des échantillons sanguins prélevés feront l’objet d’analyses biologiques sur place (viscosité sanguine par exemple), d’autres seront ramenés congelés en France pour être soumis à des analyses spécifiques (génétiques et épigénétiques notamment).
Les résultats obtenus doivent permettre d’identifier les mécanismes développés par l’organisme humain pour vivre avec moins d’oxygène : ceux développés au fil des générations par les Péruviens vivant en altitude, y compris du point de vue génétique, et ceux sur lesquels il serait possible d’agir afin d’aider l’organisme de personnes manquant d’oxygène à préserver un état de santé suffisant. La publication des premiers résultats de l’équipe se fera à partir de septembre 2019.
Un savoir-faire éprouvé
Cette expédition scientifique fait suite à d’autres déjà conduites par la même équipe de chercheurs :
– en 2011, un véritable laboratoire a été reconstitué dans le massif du Mont-Blanc à 4 300 m d’altitude pour étudier les modifications cérébrales lors d’une exposition en haute altitude de sujets habitant en plaine ;
– en 2015, l’équipe a mené une expédition scientifique internationale dans l’Himalaya regroupant 7 pays pour étudier les adaptations cardiorespiratoires et métaboliques de 50 sujets volontaires réalisant un trek jusqu’à plus de 5 000 m d’altitude.
Ces deux projets scientifiques ont conduit à la publication de nombreux articles scientifiques internationaux ainsi qu’au développement de certaines technologies et brevets. Deux articles publiés dans Neurology en 2013 et dans Frontiers in Physiology en 2016 ont par exemple démontré pour la première fois par IRM les modifications cérébrales associées à un séjour d’une semaine à plus de 4 000 m d’altitude.
Un brevet relatif au masque évoqué plus haut a été déposé et mis au point en laboratoire et a déjà été testé dans ces deux précédentes expéditions. Son utilisation augmente de 8 à 9 % la saturation (quantité d’oxygène dans le sang) en haute altitude, ce qui équivaut à reproduire des conditions d’oxygénation pour l’organisme correspondant à une altitude plus basse de 1 000 à 1 500 m que celle à laquelle se trouve réellement l’utilisateur.
Un vaste dispositif de communication
Conscients du caractère exceptionnel de cette mission scientifique et humanitaire, les chercheurs partageront chaque jour leur quotidien sur place grâce à l’implication de spécialistes en communication, dont certains seront présents au Pérou pendant l’expédition. Pour cela, un site internet, une page Facebook et un compte Instagram ont été créés. L’expédition sera également à suivre sur les réseaux sociaux de l’Inserm (Twitter, Facebook). Un documentaire sera réalisé sur place par un vidéaste professionnel.
Retour en vidéo sur la conférence de presse du 6 Novembre 2018