Pandoravirus quercus
La famille de virus géants pandoravirus s’enrichit de trois nouveaux membres, isolés par des chercheurs du laboratoire Information génomique et structurale (CNRS/Aix‐Marseille Université), associés au laboratoire Biologie à grande échelle (CEA/Inserm/Université Grenoble‐Alpes) et au CEA-Genoscope. Lors de sa découverte1, cette famille de virus avait étonné par son étrangeté – génomes géants, nombreux gènes sans équivalent connu. Dans Nature Communications le 11 juin 2018, les chercheurs proposent une explication : les pandoravirus seraient des fabriques à nouveaux gènes – et donc à nouvelles fonctions. De phénomènes de foire à innovateurs de l’évolution, les virus géants continuent de secouer les branches de l’arbre de la vie !
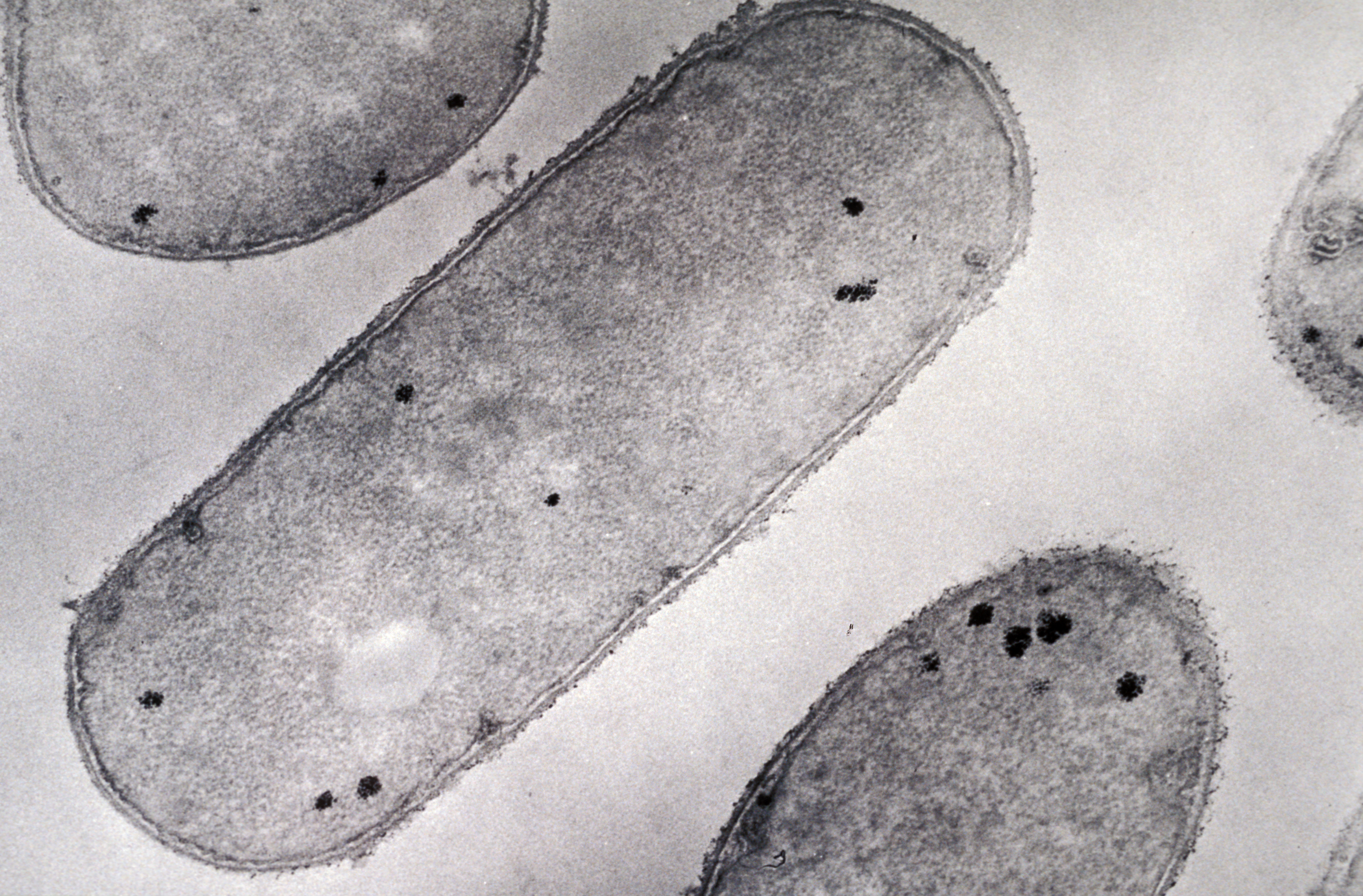
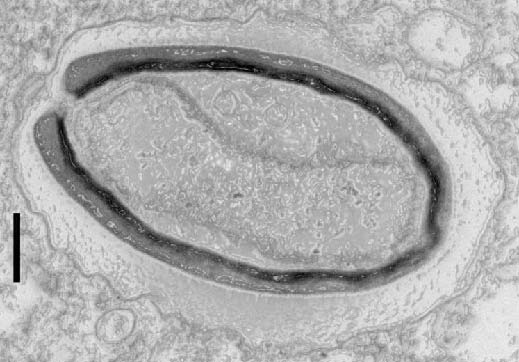
En 2013, la découverte de deux virus géants ne ressemblant à rien de connu brouillait la frontière entre monde viral et monde cellulaire[1]. Ces pandoravirus sont aussi grands que des bactéries et dotés de génomes plus complexes que ceux de certains organismes eucaryotes[2]. Mais leur étrangeté – une forme inédite d’amphore, un génome énorme[3] et atypique – posait aussi la question de leur origine.
La même équipe a depuis isolé trois nouveaux membres de la famille à Marseille, Nouméa et Melbourne. Avec un autre virus trouvé en Allemagne, cela fait désormais six cas connus que l’équipe a comparés par différentes approches. Ces analyses montrent que, malgré une forme et un fonctionnement très similaires, ils ne partageant que la moitié de leurs gènes codant pour des protéines. Or, les membres d’une même famille ont généralement bien plus de gènes en commun…
De plus, ces nouveaux membres de la famille possèdent un grand nombre de gènes orphelins, c’est‐à‐dire codant pour des protéines sans équivalent dans le reste du monde vivant (c’était déjà le cas pour les deux premiers pandoravirus découverts). Cette caractéristique inexpliquée est au cœur de tous les débats sur l’origine des virus. Mais ce qui a le plus étonné les chercheurs, c’est que ces gènes orphelins sont différents d’un pandoravirus à l’autre, rendant de plus en plus improbable qu’ils aient été hérités d’un ancêtre commun à toute la famille !
Analysés par différentes méthodes bioinformatiques, ces gènes orphelins se sont révélés très semblables aux régions non‐codantes (ou intergéniques) du génome des pandoravirus. Face à ces constats, un seul scénario pourrait expliquer à la fois la taille gigantesque des génomes des pandoravirus, leur diversité et leur grande proportion de gènes orphelins : une grande partie des gènes de ces virus naîtrait spontanément et au hasard dans les régions intergéniques. Des gènes « apparaissent » donc à des endroits différents d’une souche à l’autre, ce qui explique leur caractère unique.
Si elle est avérée, cette hypothèse révolutionnaire ferait des virus géants des artisans de la créativité génétique, qui est un élément central, mais encore mal expliqué, de toutes les conceptions de l’origine de la vie et de son évolution.
[1] Communiqué de presse du 18 juillet 2013 : https://www2.cnrs.fr/presse/communique/3173.htm
[2] Organismes dont les cellules sont dotées de noyaux, contrairement aux deux autres règnes du vivant, les bactéries et les archées.
[3] Jusqu’à 2,7 millions de bases.
Ces recherches ont bénéficié, entre autres, d’un financement de la Fondation Bettencourt Schueller à Chantal Abergel, lauréate 2014 du prix « Coup d’élan pour la recherche française ».