Le
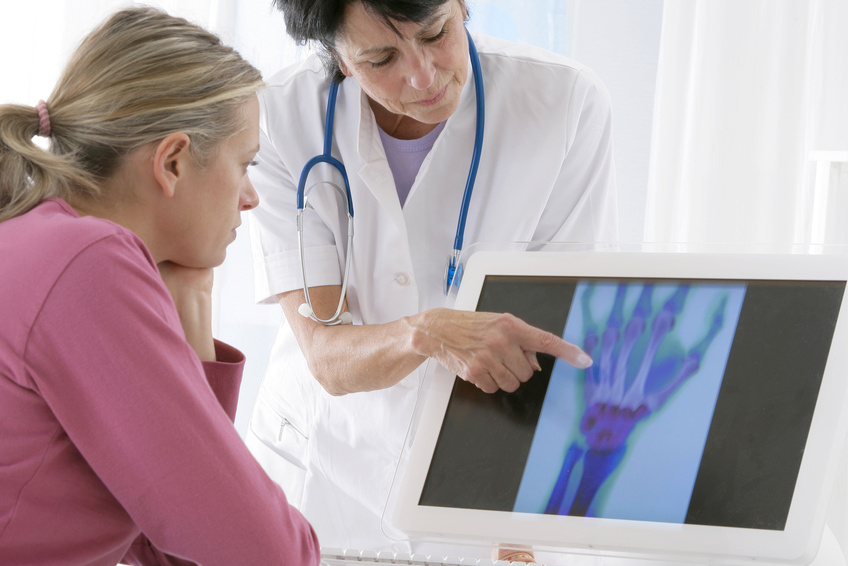
Les interactions humaines sont permises par un ensemble de mécanismes neurocognitifs définis par la notion de « cognition sociale ». Afin de détecter les patients atteints de troubles de la cognition sociale, les spécialistes utilisent des tests d’évaluation validés internationalement. Or, ces tests sont pour la plupart développés dans des pays occidentaux industrialisés, ce qui peut questionner la pertinence de les généraliser à l’ensemble de l’humanité. Une équipe de recherche de l’Inserm, du CHU Lille et de l’Université de Lille au sein du laboratoire Lille Neuroscience & cognition s’est intéressée à l’impact des différences culturelles sur les performances à deux des tests neurocognitifs les plus utilisés à travers le monde, en comparant les résultats de presque 600 participants sains à travers 12 pays. Leur étude, à paraître dans Neuropsychology, pointe des différences notables de performances d’un pays à l’autre et invite à prendre davantage en compte les sciences sociales dans le développement des tests neurocognitifs.
La notion de « cognition sociale » désigne l’ensemble des processus cognitifs (perception, mémorisation, raisonnement, émotion…) qui interviennent dans les interactions sociales. Les troubles de la cognition sociale se retrouvent dans de nombreuses maladies comme la schizophrénie ou la maladie de Parkinson, et dans les troubles neurodéveloppementaux comme l’autisme. Ils sont à l’origine de difficultés interpersonnelles très incapacitantes qui impactent fortement la vie des patients et de leur entourage. Par conséquent, la détection, la qualité de l’évaluation et le traitement de ces troubles représentent un enjeu majeur pour les spécialistes en santé mentale.
Pour évaluer les capacités de cognition sociale et diagnostiquer un éventuel trouble, il existe des tests utilisés internationalement, qui mesurent ce qu’on appelle les « fonctions cognitives », c’est-à-dire les capacités qui nous permettent d’interagir efficacement avec d’autres personnes.
Or, ces tests cognitifs de référence ont, pour la plupart, été développés dans des démocraties occidentales et industrialisées. Leurs « normes » sont par conséquent définies en grande majorité à partir de profils de personnes blanches, aisées et à haut niveau d’éducation. Dans la mesure où ces personnes ne constituent que 12 % de l’humanité, leur surreprésentation dans le développement des tests neuropsychologiques questionne la pertinence de l’application de ces derniers à d’autres populations.
Une équipe de recherche dirigée par le chercheur Inserm Maxime Bertoux au sein du laboratoire Lille Neuroscience & cognition (Inserm/CHU Lille/Université de Lille) a cherché à déterminer si les différences culturelles ont un impact notable sur les résultats aux tests de cognition sociale les plus couramment utilisés. Pour cela, les chercheurs et chercheuses ont réalisé une vaste étude internationale sur 587 participants sains, de 18 à 89 ans, à travers 12 pays (Allemagne, Angleterre, Argentine, Brésil, Canada, Chili, Chine, Colombie, Espagne, France, Italie, Russie). Des neuropsychologues ont soumis les participants à deux types de tests évaluant des capacités considérées comme primordiales dans la cognition sociale.
Le premier, créé au Royaume-Uni, a pour objectif d’évaluer la capacité à décoder les règles sociales et à comprendre l’état mental d’un interlocuteur en demandant aux participants d’identifier dans divers petits scénarii, si l’un des protagonistes commet un « faux pas » social (par exemple, confondre un client avec un serveur dans un restaurant). Le second test, créé aux États-Unis, évalue la capacité à reconnaître les émotions exprimées par le visage d’un interlocuteur, en demandant aux participants d’identifier diverses expressions faciales sur des photographies.
Les résultats de l’étude montrent qu’une part importante des écarts de performance à ces deux tests (environ un quart pour le test du faux pas et plus de 20 % pour le test de reconnaissance des émotions) est à attribuer aux différences de nationalité entre les participants.
Les meilleures performances au test des faux pas sont obtenues par les participants anglais, sans que la traduction littérale de l’anglais vers la langue d’origine des autres participants n’ait d’impact sur les résultats.
Par exemple, 100 % des participants anglais considèrent comme un faux pas de confondre un client et un serveur dans un restaurant contre seulement 65 % des participants canadiens. Ou encore, alors que 100 % des participants anglais considèrent qu’il est normal de céder sa place dans un bus à une personne âgée, 21 % des participants chinois considèrent qu’il s’agit d’un faux pas.
Dans les résultats au test de reconnaissance des expressions faciales émotionnelles, la comparaison entre les pays révèle que certaines émotions ne sont pas identifiées de manière consensuelle par tous les participants : si les expressions positives comme la joie, sont interprétées sans ambiguïté d’un pays à l’autre, l’interprétation des émotions négatives est beaucoup plus variable. Par exemple, la peur est confondue avec la surprise par la majorité des participants canadiens et brésiliens tandis qu’anglais et argentins n’ont quasiment aucune difficulté à les différencier.
« Cette étude montre que les facteurs individuels et culturels impactent fortement les mesures de cognition sociale, déclare Maxime Bertoux. Au-delà de l’effet de l’âge, du genre et de l’éducation, il y a une influence des concepts locaux, des normes et des habitudes sur la catégorisation des émotions, l’identification des intentions et la compréhension du comportement d’autres personnes. » Ainsi, l’utilisation de tests conçus par des scientifiques américains ou anglais, blancs et aisés, favoriserait la performance des participants issus du même pays, de la même culture et du même niveau social.
« Bien sûr, cela ne veut pas dire que les habitants d’un pays sont meilleurs ou moins bons que ceux d’un autre, précise le chercheur. Notre étude montre qu’un test créé dans un contexte particulier favorise les personnes qui sont familières avec ce contexte. Par exemple, identifier un faux pas requiert de détecter qu’une règle sociale implicite a été brisée, or, les règles sociales fluctuent d’un pays à l’autre. »
Ces résultats questionnent donc l’applicabilité internationale d’un test neuropsychologique conçu et validé dans un pays en particulier pour l’évaluation et le diagnostic des troubles cognitifs.
Dans de prochaines études, l’équipe de recherche souhaiterait enrichir ses données en incluant davantage de participants et de pays – en particulier de régions du monde non représentées dans ces travaux, comme l’Afrique et le Moyen-Orient –, mais aussi en explorant les variations neurocognitives et culturelles au sein même de pays étendus comme la Chine ou le Canada. « Les neurosciences doivent interagir davantage avec les sciences sociales dans la connaissance et la prise en compte des diversités culturelles afin de construire une neuropsychologie plus rigoureuse, pertinente et inclusive », conclut Maxime Bertoux.