 © Inserm
© Inserm
Jeudi 27 novembre, l’Inserm célèbrera par la remise de ses prix annuels celles et ceux qui font avancer la recherche en santé. Les travaux des cinq scientifiques récompensés lors de cette édition 2025 reflètent l’utilité et le caractère innovant des recherches qui sont menées au sein de l’Institut.
Le Grand Prix Inserm 2025 est décerné à Marc Humbert, médecin pneumologue et chercheur qui a consacré sa carrière à mieux comprendre l’hypertension artérielle pulmonaire et à améliorer la prise en charge des patients.
« Les parcours des lauréates et lauréats 2025 témoignent cette année encore de l’excellence de la recherche à l’Inserm, où l’interdisciplinarité et la synergie des équipes transforment la recherche en innovations majeures et en avancées concrètes pour les patients, déclare le Pr Didier Samuel, PDG de l’Inserm. Leurs travaux, marqués par une exigence scientifique constante, concrétisent l’ambition de l’Institut : faire progresser la santé des tous nos concitoyens et apporter des réponses aux enjeux médico-sociétaux actuels et futurs. »
La cérémonie des Prix Inserm sera retransmise en direct du Collège de France, jeudi 27 novembre 2025 dès 18h30 : voir la cérémonie.
Les lauréats 2025
Marc Humbert, Grand Prix
 © Inserm/François Guénet
© Inserm/François Guénet
Doyen de la Faculté de médecine de l’Université Paris-Saclay, chef du service de pneumologie et soins intensifs respiratoires à l’hôpital Bicêtre (AP-HP) et directeur de l’unité Hypertension pulmonaire : physiopathologie et innovation thérapeutique (Inserm / Université Paris-Saclay), Marc Humbert est l’un des spécialistes mondiaux de l’hypertension artérielle pulmonaire. Ses travaux ont ouvert la voie à des thérapies innovantes qui ont transformé la prise en charge des patients dont l’espérance de vie a plus que doublée en 20 ans.
Après un diplôme d’études spécialisées de pneumologie et une thèse en immunologie, Marc Humbert effectue un postdoctorat à l’Imperial College à Londres – avec qui il collabore toujours aujourd’hui.
À son retour en France en 1995, Marc Humbert décide d’explorer en profondeur les mécanismes de l’hypertension artérielle pulmonaire (HTAP), une maladie rare causée par un remodelage des petites artères pulmonaires et caractérisée par une augmentation progressive de la pression artérielle pulmonaire, conduisant à une insuffisance cardiaque sévère. À l’époque, sa rareté et les symptômes peu spécifiques au début de la maladie la rendent difficile à diagnostiquer, et l’espérance de vie une fois le diagnostic posé est de moins de trois ans. On ne connaît alors pas de gène responsable des formes familiales de la maladie et les premiers traitements qui ont vu le jour dans les années 1990 doivent être administrés par perfusion intraveineuse continue.
Au fil des ans, Marc Humbert va mettre en place une biobanque et une collection de tissus pulmonaires provenant de patients atteints d’HTAP ou d’autres formes rares d’hypertension pulmonaire. Au sein du service qu’il dirige à l’hôpital Bicêtre, son équipe va également établir l’un des plus grands registres mondiaux de l’hypertension pulmonaire, avec plus de 18 000 cas répertoriés. Le service sera labellisé « centre de référence » pour la maladie dès le premier plan national Maladies rares en 2004.
Marc Humbert est l’un des premiers à discuter du rôle de l’inflammation dans l’HTAP. Parmi ses principales découvertes, il a montré avec son équipe que le dysfonctionnement de la couche interne des vaisseaux est le point de départ du remodelage vasculaire : une découverte à la base de traitements innovants, testés dans de grands essais internationaux qu’il a contribué à concevoir. Enfin, ses observations sur les origines génétiques de la maladie ont permis l’émergence d’un tout nouveau traitement qui vient de faire ses preuves dans quatre essais cliniques successifs : le sotatercept.
Marc Humbert est également coordinateur scientifique de Destination 2024, un projet de recherche hospitalo-universitaire, soutenu par l’Agence nationale de la recherche dans le cadre du programme d’Investissements d’avenir. Destination 2024 vise à améliorer le traitement de l’hypertension pulmonaire et à favoriser le diagnostic précoce de l’une de ses formes, l’hypertension pulmonaire thromboembolique chronique, grâce au développement d’outils de diagnostic et d’aide au traitement interventionnel.
Le Grand Prix Inserm 2025 qui lui est décerné vient récompenser l’excellence des activités de recherche de Marc Humbert et son engagement en tant que médecin, tous deux mis au service des malades : « Nous avons la chance de travailler avec des spécialistes de nombreuses disciplines : biologistes, ingénieurs, médecins, chirurgiens, spécialistes des bases de données et de l’intelligence artificielle en santé… L’interdisciplinarité est très féconde, déclare-t-il. Aujourd’hui, je suis fier de recevoir ce prix au nom de mon équipe et pour tous les patients qui nous font confiance au quotidien. »
Mohamed-Ali Hakimi, Prix Recherche
 © Inserm/François Guénet
© Inserm/François Guénet
Directeur de recherche Inserm, responsable de l’équipe Toxoplasmose & coévolution hôte-parasite, à l’Institut pour l’avancée des biosciences (Inserm / CNRS / Université Grenoble Alpes), Mohamed-Ali Hakimi explore les rouages génétiques et épigénétiques de Toxoplasma gondii, le parasite responsable de la toxoplasmose.
Après un parcours international pluridisciplinaire, Mohamed-Ali Hakimi se tourne vers la parasitologie. Il intègre l’Inserm en 2004, à la tête d’une équipe ATIP-Avenir[1] avec la toxoplasmose comme terrain d’étude.
Le parasite Toxoplasma gondii connaît un cycle de vie complexe. Transmis à l’humain via l’alimentation ou par contact avec les selles d’un chat infecté, Toxoplasma gondii infecte environ un tiers de la population. Si les symptômes sont bénins la plupart du temps, les atteintes peuvent être sévères chez les personnes immunodéprimées, ou pour le fœtus quand la femme enceinte est touchée.
Avec son équipe, Mohamed-Ali Hakimi a décrypté les mécanismes épigénétiques permettant l’alternance entre les formes sexuée et asexuée du parasite et identifié la protéine clé derrière ce phénomène. Ces découvertes devraient permettre d’identifier de nouvelles molécules ciblant les protéines présentes dans la forme sexuée et infectieuse du parasite chez le chat, pour lutter contre la transmission de la toxoplasmose à l’humain.
Sarah Zohar, Prix Innovation
 © Inserm/François Guénet
© Inserm/François Guénet
Directrice de recherche Inserm et responsable de l’unité Health data- and model-driven approaches for knowledge acquisition (HeKA, Inserm / Inria / Université Paris Cité), Sarah Zohar s’impose comme l’une des figures de proue de la recherche en santé numérique. Son credo : utiliser les données, la modélisation et les simulations pour mieux évaluer médicaments et dispositifs médicaux numériques, au bénéfice direct des patients.
Sarah Zohar a rejoint l’Inserm en 2005 au sein d’un centre d’investigation clinique. En conjuguant les biomathématiques et les biostatistiques, elle travaille à faire progresser la représentation et la modélisation des données de santé
Sarah Zohar pilote le programme européen Invents, qui a pour ambition de palier la faiblesse statistique des essais cliniques de petits effectifs – comme dans les maladies rares, et plus particulièrement en pédiatrie, où il y a peu de patients –, en développant des essais cliniques in silico se fondant sur des modèles et des simulations, tout en respectant les contraintes des agences règlementaires.
Dans le cadre de ce programme, elle est parvenue, à convaincre les groupes pharmaceutiques de partager la plus grande quantité de données d’essais cliniques qui ne l’a jamais été dans le cadre d’un projet de recherche avec des académiques en Europe. Mais elle est également parvenue à faire travailler dans le même consortium des acteurs majeurs dans l’accès au marché européen du médicament. L’ambition de Sarah Zohar : qu’Invents permette à terme de garantir aux patients un accès à des traitements innovants.
Nabila Bouatia-Naji, Prix Science et société-Opecst
 © Inserm/François Guénet
© Inserm/François Guénet
Directrice de recherche Inserm au Paris centre de recherche cardiovasculaire (Parcc, Inserm / Université de Paris), Nabila Bouatia-Naji s’intéresse aux gènes de prédisposition à des maladies cardiovasculaires touchant majoritairement les femmes.
Après une thèse dans un laboratoire Inserm et un post-doctorat à Cambridge, Nabila Bouatia-Naji est recrutée à l’Inserm et rejoint le Parcc en 2011. Elle s’intéresse à la dysplasie fibromusculaire, une pathologie artérielle méconnue qui touche majoritairement les femmes. Elle identifie un premier emplacement chromosomique, lié non seulement à la dysplasie fibromusculaire mais aussi à la dissection coronarienne spontanée, une forme peu connue de l’infarctus qui partage des liens cliniques avec la dysplasie fibromusculaire. À la suite de cette découverte, elle obtiendra en 2017 une bourse Starting Grant du Conseil européen de la recherche et fondera son équipe de recherche.
Nabila Bouatia-Naji va impulser des collaborations internationales dans l’objectif de combiner toutes les cohortes avec ADN disponible qui existent sur la dysplasie et la dissection coronarienne. Une initiative qui lui permettra de conduire deux grandes analyses génétiques sur ces maladies artérielles atypiques : à ce jour, 18 gènes de prédisposition ont pu être identifiés.
En 2019, après un appel sur les réseaux sociaux, la chercheuse établit un pont entre la recherche en génétique et la société en contribuant à la création du site scadinfo.fr. Dédié à la dissection coronarienne spontanée, ce site se présente comme un outil pour mieux informer et soutenir les patientes.
Guillaume Fusai, Prix Appui à la recherche
 © Inserm/François Guénet
© Inserm/François Guénet
À la tête du pôle Europe de l’Inserm, Guillaume Fusai aide les chercheuses et chercheurs à décrocher des projets et à renforcer les liens avec les meilleurs laboratoires du continent.
Depuis son arrivée à l’Inserm en 2018 comme responsable du pôle Europe, Guillaume Fusai a travaillé à la mise en place d’une cellule Europe. Celle-ci intègre des représentants des Ressources humaines et de la direction des Affaires financières, et collabore étroitement avec les délégations régionales et Inserm Transfert, la filiale privée de l’Institut qui assure le transfert de technologies issues de ses laboratoires.
En miroir des collaborations qu’exige la participation aux projets européens, cette cellule Europe est un outil nécessaire pour encourager les chercheurs et chercheuses à répondre aux appels à projets européens, identifier leurs besoins et les accompagner. Une grande partie de son activité est aussi dédiée à développer les partenariats bilatéraux pour créer des liens forts avec des organismes étrangers d’excellence.
Dans le programme-cadre Horizon 2020, l’Inserm était le premier organisme au niveau du défi sociétal Santé et le deuxième récipiendaire des bourses du Conseil européen de la recherche. Pour Horizon Europe qui a pris la suite (2021-2027), l’objectif de Guillaume Fusai est d’augmenter encore les résultats de l’Inserm.
Charles Swanton, Prix international
 © Ambassade de France à Londres
© Ambassade de France à Londres
Le 27 octobre 2025 à la Résidence de France à Londres, lors d’une journée mettant à l’honneur la fructueuse collaboration de l’Institut avec ses partenaires britanniques, l’Inserm a remis le prix international 2025 à Charles Swanton, chercheur et clinicien britannique spécialiste du cancer.
Directeur clinique adjoint du Francis Crick Institute à Londres, où il dirige le laboratoire Cancer Evolution and Genome Instability dédié à l’évolution des cancers et à l’instabilité du génome, Charles Swanton s’intéresse à l’histoire évolutive des tumeurs solides, aux processus génétiques à l’origine des différences entre les cellules au sein d’une même tumeur et à l’impact de cette diversité sur l’efficacité du système immunitaire et sur le pronostic des patients.
Le prix Inserm international 2025 vient récompenser son engagement dans la coopération franco-britannique, notamment à travers ses travaux de recherche en collaboration avec des équipes Inserm de Gustave-Roussy.
Les Prix Inserm
Le Grand Prix rend hommage à un acteur ou une actrice de la recherche scientifique française dont les travaux ont permis des progrès remarquables dans la connaissance de la physiologie humaine, en thérapeutique et, plus largement, dans la recherche en santé.
Le Prix Recherche distingue un chercheur ou une chercheuse, un enseignant-chercheur ou une enseignante-chercheuse ou enfin un clinicien chercheur ou une clinicienne chercheuse dont les travaux ont particulièrement marqué le champ de la recherche fondamentale, de la recherche clinique et thérapeutique et de la recherche en santé publique.
Le Prix Innovation revient à un chercheur ou une chercheuse dont les travaux ont fait l’objet d’une valorisation entrepreneuriale.
Le Prix Science et société-Opecst récompense un chercheur ou une chercheuse, ou un personnel d’appui ou d’accompagnement de la recherche qui s’est distingué dans le domaine de la valorisation de la recherche et par sa capacité à être en dialogue avec la société et à l’écoute des questions des citoyens sur leur santé.
Le Prix Appui à la recherche enfin est décerné à un personnel d’appui ou d’accompagnement de la recherche pour des réalisations marquantes au service de l’accompagnement de la recherche.
[1] Programme qui permet aux jeunes chercheurs CNRS et Inserm de constituer leur propre équipe de recherche dans les domaines des sciences de la vie et de la santé





 L’équipe de recherche a examiné les impacts sur le comportement de l’exposition à douze substances suspectées ou reconnues comme des perturbateurs endocriniens pendant la grossesse (image d’illustration). © Adobe Stock
L’équipe de recherche a examiné les impacts sur le comportement de l’exposition à douze substances suspectées ou reconnues comme des perturbateurs endocriniens pendant la grossesse (image d’illustration). © Adobe Stock











 © Adobe Stock
© Adobe Stock


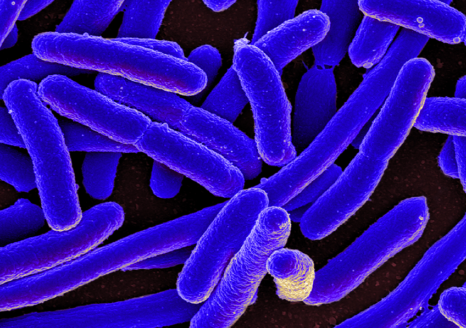 Micrographie électronique à balayage d’Escherichia coli. © National Institute of Allergy and Infectious Diseases, National Institutes of Health
Micrographie électronique à balayage d’Escherichia coli. © National Institute of Allergy and Infectious Diseases, National Institutes of Health
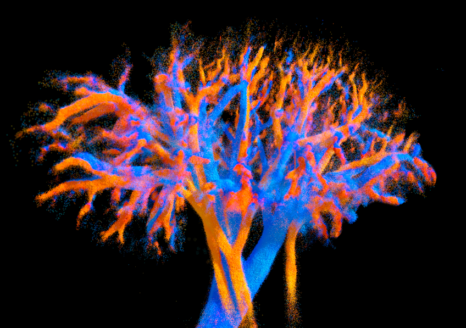 Visualisation 4D de la vascularisation d’un rein entier obtenue grâce à la sonde multi-lentille développée dans cette étude. Les veines sont représentées en bleu et les artères en rouge. Les variations de couleur indiquent la vitesse du flux sanguin : plus la couleur est vive, plus le sang circule rapidement. Les plus petits vaisseaux font moins de 100 micromètres. © Alexandre Dizeux, Physics for Medicine /Inserm
Visualisation 4D de la vascularisation d’un rein entier obtenue grâce à la sonde multi-lentille développée dans cette étude. Les veines sont représentées en bleu et les artères en rouge. Les variations de couleur indiquent la vitesse du flux sanguin : plus la couleur est vive, plus le sang circule rapidement. Les plus petits vaisseaux font moins de 100 micromètres. © Alexandre Dizeux, Physics for Medicine /Inserm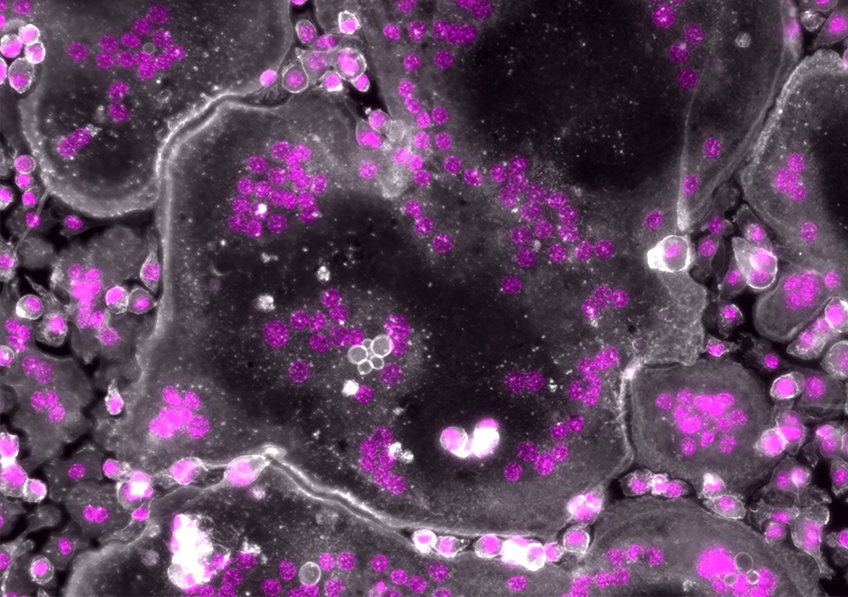
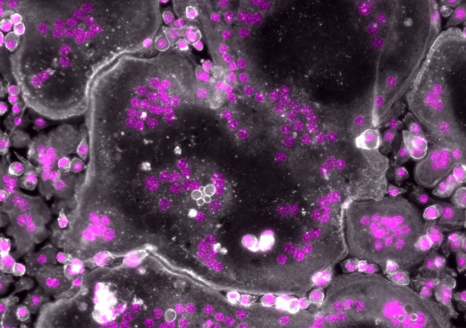 En l’absence de moésine, les ostéoclastes humains présentent des noyaux surnuméraires (en rose). L’actine est représentée en blanc. – Microscopie à fluorescence © Ophélie Dufrançais
En l’absence de moésine, les ostéoclastes humains présentent des noyaux surnuméraires (en rose). L’actine est représentée en blanc. – Microscopie à fluorescence © Ophélie Dufrançais