Dans le cadre d’un projet mené par des équipes de l’université de Cambridge et du Sanger Institute, en collaboration avec une équipe de l’Institut Pasteur et de l’Inserm, des chercheurs montrent pour la première fois que des cellules souches adultes appelées iPS (1), produites à partir de cellules de patients atteints d’une maladie du foie, peuvent être génétiquement corrigées puis différenciées en cellules hépatiques pour participer à une régénération du foie dans un modèle animal. Ces travaux, publiés le 12 octobre sur le site de la revue Nature, constituent une preuve de concept majeure pour envisager le recours futur à ces cellules souches chez l’Homme, en vue d’une thérapie génique.
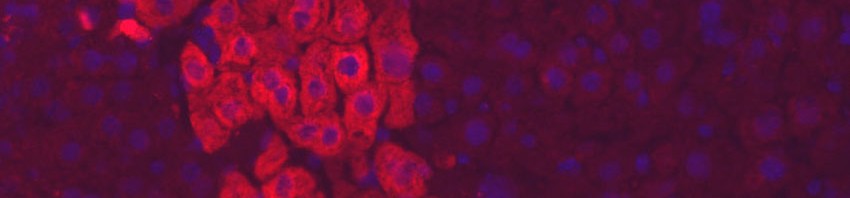
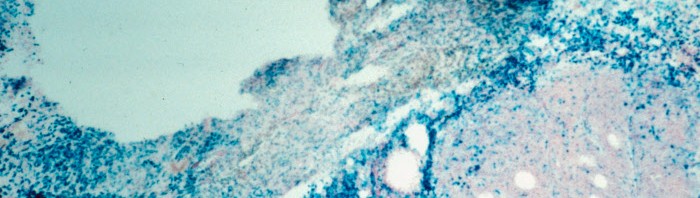
© Institut Pasteur – Cellules iPS humaines différenciées en hépatocytes (en rouge) dans une coupe de foie de souris. Les noyaux des cellules sont visibles en bleu.
Depuis quelques années, les scientifiques savent produire des cellules ayant les propriétés de cellules souches à partir de cellules déjà matures et spécialisées de notre organisme, comme celles de la peau. Ces cellules souches, appelées « iPS », sont dites « pluripotentes » : elles peuvent fournir des cellules spécialisées, sur commande, possédant le même patrimoine génétique que les cellules d’origine. Les cellules iPS constituent une base potentielle à l’exploration de nombreux domaines thérapeutiques, notamment celui des greffes ou de la thérapie génique. Pour autant, les travaux menés sur ces cellules n’avaient pas à ce jour apporté de preuve de leur efficacité potentielle in vivo pour de telles utilisations.
Des chercheurs du Sanger Institute et de l’université de Cambridge (Royaume-Uni), avec la collaboration d’une équipe française Institut Pasteur/Inserm, viennent pour la première fois de démontrer que les cellules dérivées de cellules souches iPS peuvent être utilisées dans le cadre d’une thérapie génique pour contribuer à pallier les effets d’une pathologie dans un modèle de souris portant une insuffisance hépatique.
Les chercheurs ont travaillé sur une maladie génétique rare qui affecte le foie. Elle est due à une mutation ponctuelle dans le gène de l’enzyme alpha-1-antitrypsine, essentielle au bon fonctionnement des cellules hépatiques. Chez l’enfant, elle se manifeste par des symptômes plus ou moins bénins (jaunisse, distension de l’abdomen…), mais peut évoluer progressivement chez l’adulte vers un emphysème pulmonaire et une cirrhose, contre laquelle le seul espoir de guérison est une transplantation de foie.
Les chercheurs de l’université de Cambridge, dirigés par Ludovic Vallier et David Lomas, et du Sanger Institute, conduits par Allan Bradley, ont dans un premier temps prélevé des cellules de la peau de patients, et les ont mises en culture in vitro afin de les « dédifférencier » et de leur conférer les propriétés de cellules souches pluripotentes : c’est le stade « cellules iPS ». Les scientifiques sont alors parvenus, par génie génétique, à corriger dans ces cellules la mutation responsable de la maladie. Ils ont ensuite engagé ces cellules souches devenues « saines » dans la voie de maturation les conduisant à se différencier en cellules du foie.
Les scientifiques de l’Institut Pasteur et de l’Inserm, menés par Hélène Strick-Marchand dans l’unité mixte Institut Pasteur/Inserm Immunité innée dirigée par James Di Santo, ont alors testé les nouvelles cellules hépatiques humaines ainsi produites sur un modèle animal atteint d’insuffisance hépatique. Leur travail a montré qu’elles étaient d’une part parfaitement fonctionnelles et aptes à s’intégrer dans le tissu existant, et d’autre part qu’elles contribuaient à la régénération du foie chez les souris traitées.
Ces travaux pionniers, publiés dans Nature, renforcent ainsi les espoirs des communautés scientifiques et médicales dans le recours aux cellules iPS à des fins thérapeutiques chez l’Homme.
Note
(1) Induced pluripotent stem cells – cellules souches pluripotentes induites