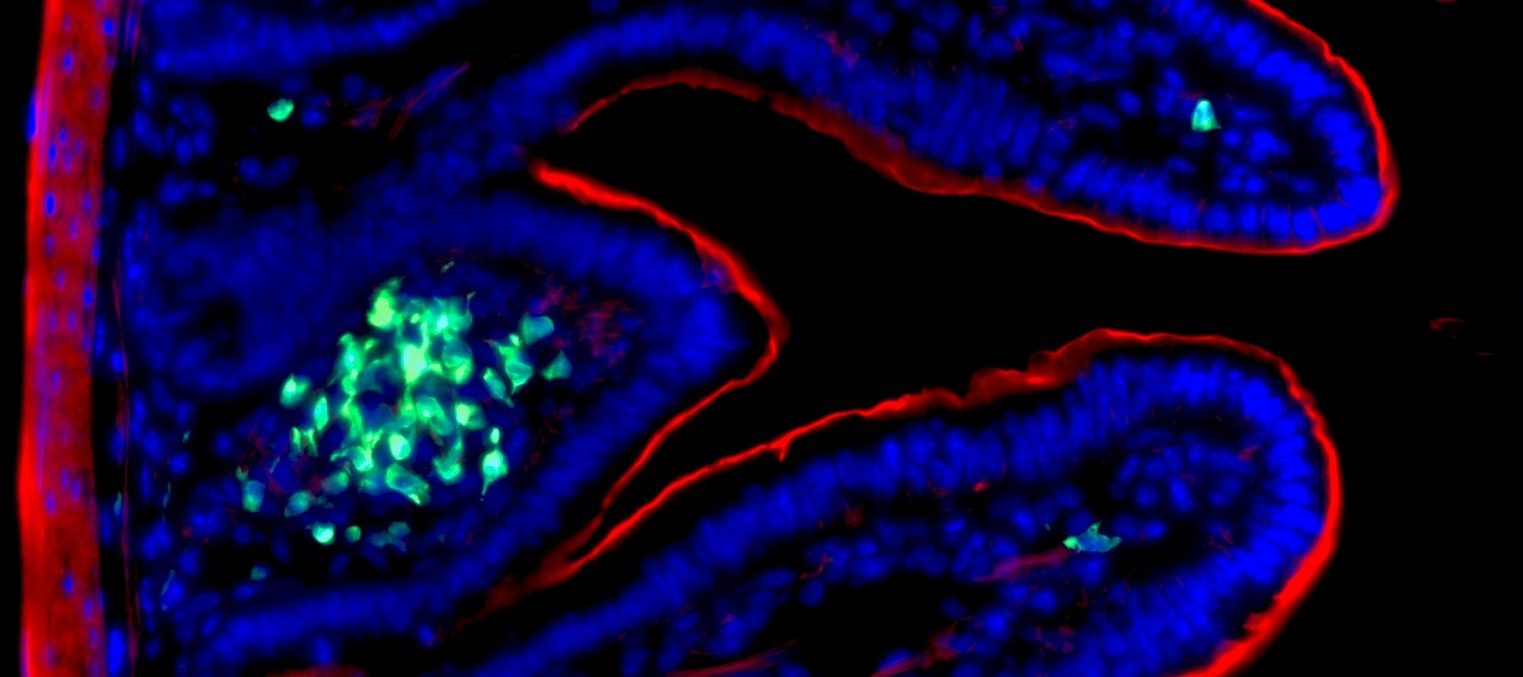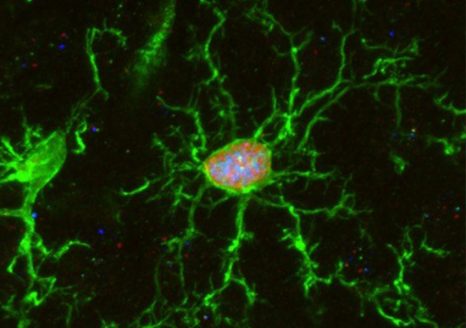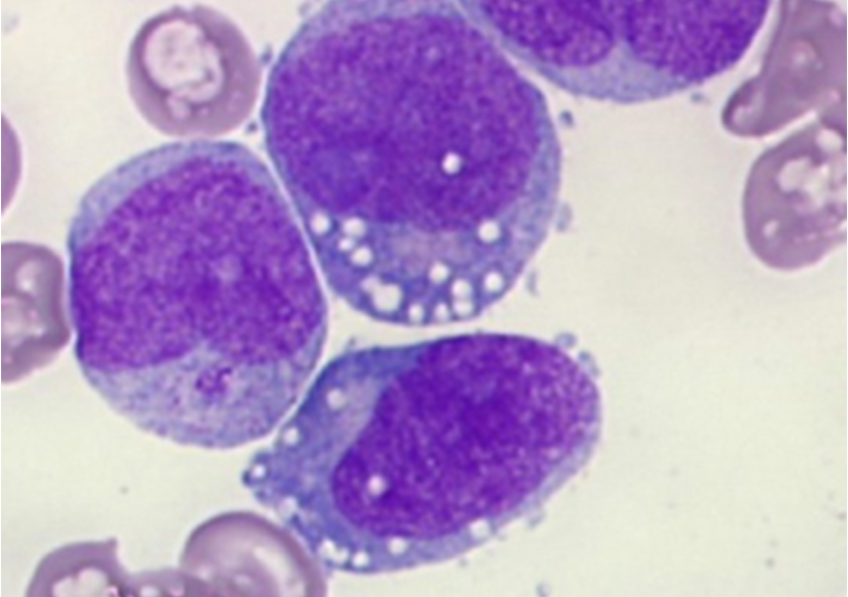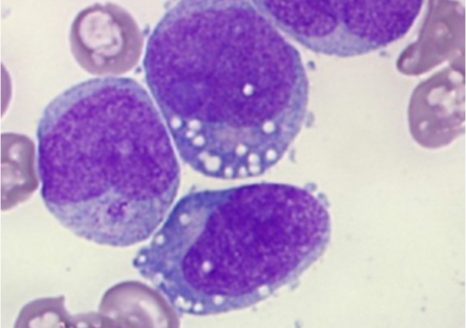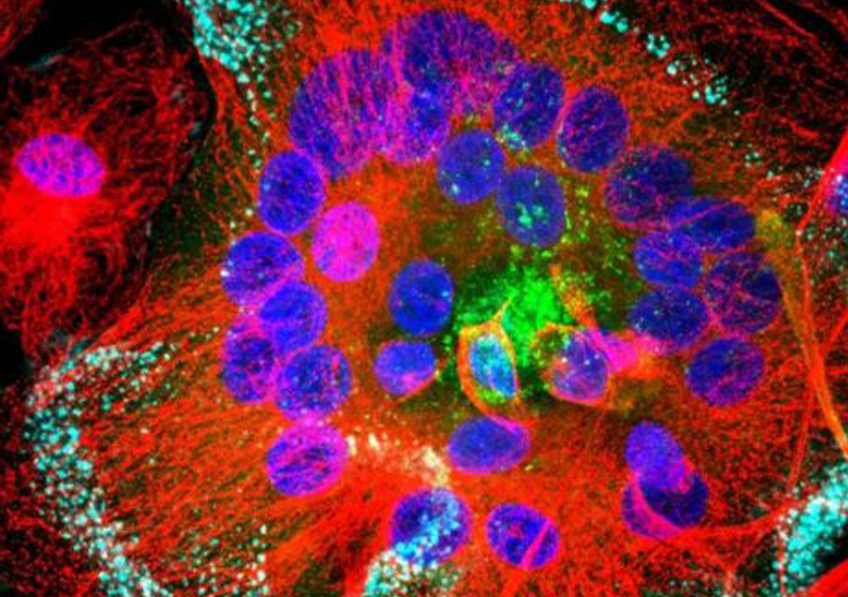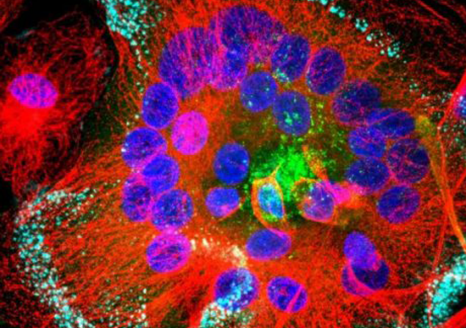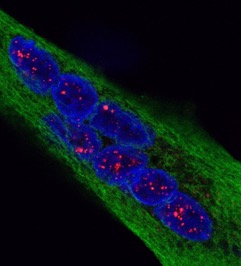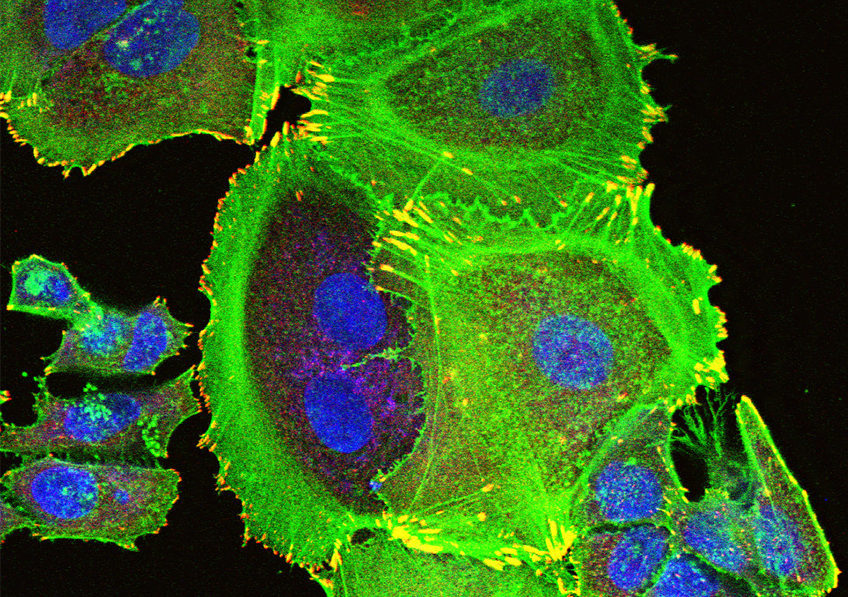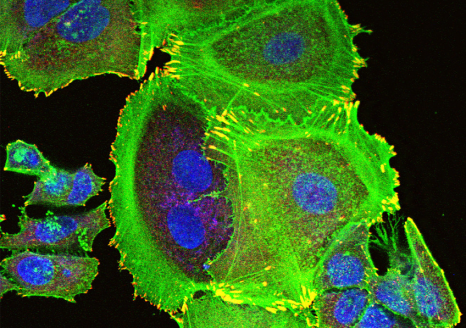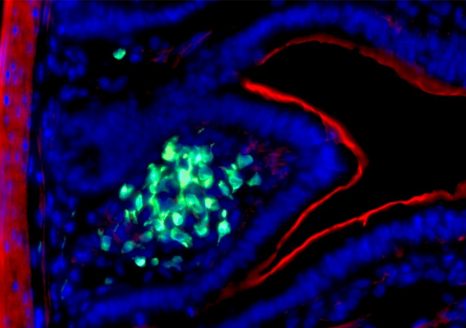
Les ILC3 (vert) dans l’intestin (noyau en bleu et actine en rouge) en microscopie à fluorescence. © Nicolas Serafini – Institut Pasteur / Inserm
Le système immunitaire des muqueuses intestinales, et particulièrement l’immunité innée, joue un rôle essentiel dans la régulation des interactions hôte-microbe et notamment dans la protection contre les pathogènes. Des chercheurs de l’Institut Pasteur et de l’Inserm ont montré, grâce à un modèle animal d’infection intestinale, que certaines cellules de l’immunité innée, les cellules lymphoïdes innées de type 3, n’agissaient pas uniquement en phase précoce de l’infection, mais qu’elles pouvaient être entraînées et pourvues d’une forme de mémoire lors d’une réinfection. Cette caractéristique était jusqu’à présent connue pour appartenir principalement aux cellules B et T de l’immunité adaptative. Cette étude est publiée dans Science, le 25 février 2022.
La lutte contre les infections à Escherichia coli responsables de pathologies ou d’hémorragies intestinales représente un enjeu mondial de santé publique. Présentes dans l’eau de boisson ou l’alimentation, ces bactéries peuvent entrainer des diarrhées persistantes, associées à une inflammation intestinale aiguë. On estime qu’elles représentent près de 9% des causes mondiales de décès chez l’enfant.
La muqueuse intestinale est pourvue d’un système défensif complexe lui permettant de lutter contre ce type d’infection, tout en maintenant une tolérance envers le microbiote, indispensable au bon fonctionnement de l’organisme. Cette surveillance constante est assurée par le système immunitaire « inné », qui organise une défense précoce dès les premières heures suivant l’infection. Puis, le système immunitaire adaptatif développe une mémoire envers les pathogènes qu’il rencontre, grâce à l’activation de récepteurs spécifiques exprimés à la surface des lymphocytes B et T, permettant ainsi la production d’anticorps protecteurs et de cytokines inflammatoires.
Contrairement au rôle clairement établi du système adaptatif dans la tolérance et la protection, celui du système inné dans le maintien de cet équilibre demeure encore peu compris.C’est en 2008[1] que l’équipe du chercheur Inserm James Di Santo (unité d’Immunité innée, Institut Pasteur / Inserm) décrit les cellules lymphoïdes innées de type 3 (« group 3 innate lymphoid cells », ILC3) comme une nouvelle famille de lymphocytes, distincte des lymphocytes T et B. Elles jouent un rôle essentiel dans la mise en place de la réponse immunitaire rapide, notamment dans les muqueuses intestinales, grâce à leur production de cytokines pro-inflammatoires, telles que l’interleukine (IL)-22.
La production de cytokines permet alors d’activer la production par les cellules épithéliales de peptides antimicrobiens, réduisant la charge bactérienne afin de maintenir l’intégrité de la barrière intestinale.
Dans cette étude, les chercheurs de l’unité d’Immunité innée (Institut Pasteur / Inserm) ont montré qu’en utilisant la bactérie intestinale murine, Citrobacter rodentium (un modèle d’infection à E. coli chez l’homme), les ILC3 persistent plusieurs mois après leur activation lors d’une infection. Ils ont appliqué un protocole innovant permettant d’exposer le système immunitaire à des quantités réduites de bactérie C. rodentium. Les scientifiques ont constaté que cette exposition limitée induit des modifications durables de la fonction des ILC3.
Ainsi, lors d’une seconde infection, les ILC3 « expérimentées » permettent un contrôle rapide de l’infection grâce à une prolifération accrue et une production massive d’IL-22.
« Nos travaux montrent que les ILC3 intestinales acquièrent une mémoire pour renforcer dans le temps les défenses de la muqueuse intestinale contre les infections répétées, » explique Nicolas Serafini, premier auteur de l’étude et chercheur Inserm au sein de l’unité d’Immunité innée (Institut Pasteur / Inserm).« La capacité à « entraîner » le système immunitaire inné au niveau des muqueuses ouvre la voie à l’amélioration de la défense de l’organisme contre une variété d’agents pathogènes qui causent des maladies humaines, » commente James Di Santo, auteur principal de l’étude et responsable de l’unité d’Immunité innée (Institut Pasteur / Inserm).
Cette découverte met en évidence un nouveau mécanisme de défense immunitaire antibactérienne et elle pourrait, à terme, ouvrir de nouvelles approches thérapeutiques contre les pathologies intestinales (MICI ou cancer).
[1] Satoh-Takayama N. et al. Immunity 2008