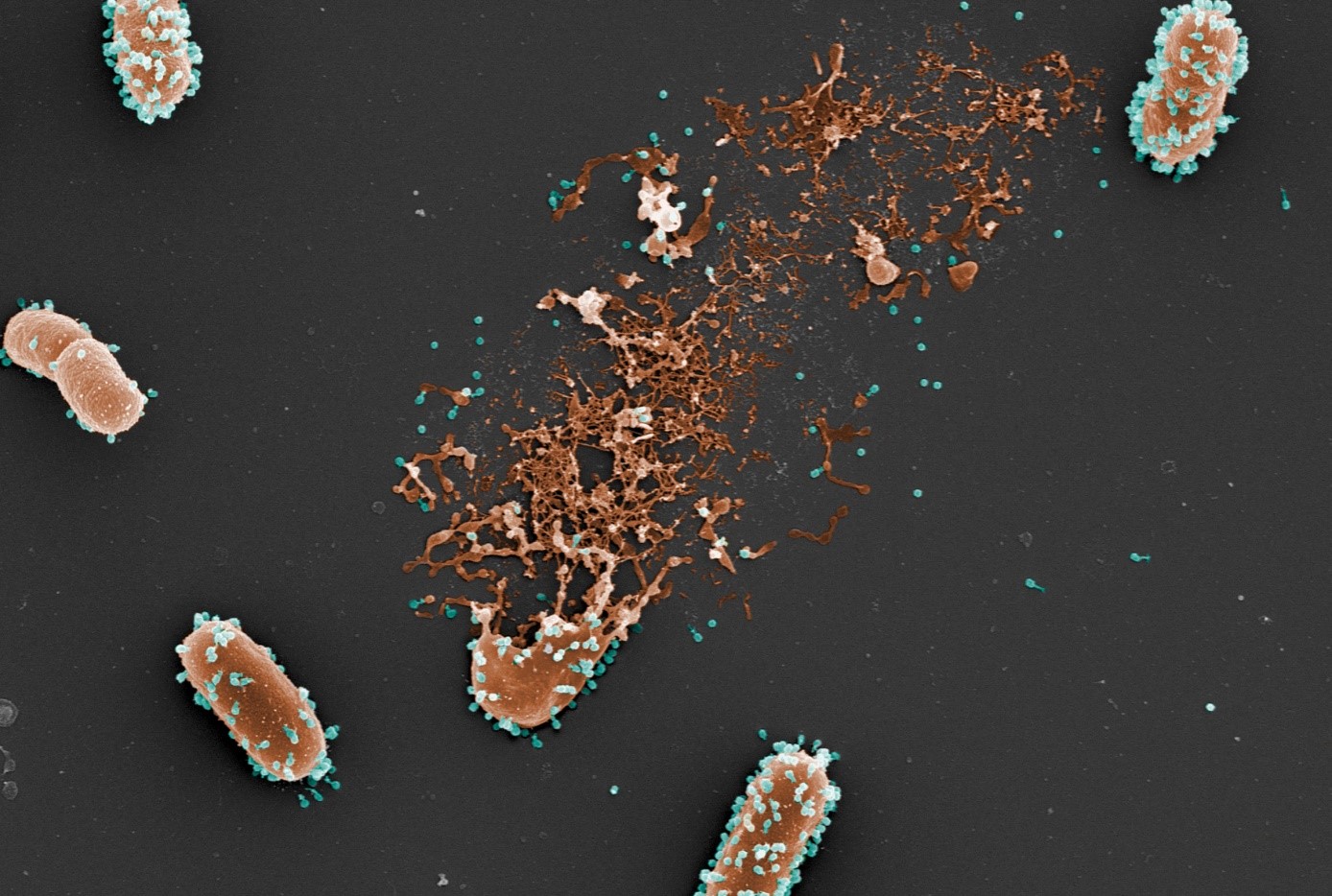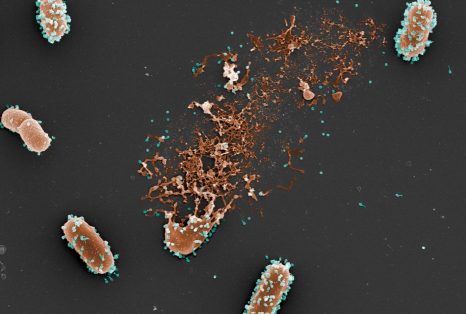
Photo (colorisée) de microscopie électronique à balayage d’une bactérie lysée par les phages (©L. Debarbieux, Institut Pasteur ; M. and C. Rohde, Helmholtz Centre for Infection Research).
L’antibiorésistance constitue aujourd’hui un défi majeur de santé publique, associé à une mortalité importante. Les bactériophages, ces virus « tueurs » de bactéries, pourraient constituer une solution afin de lutter contre les pathogènes résistants aux antibiotiques, mais leur développement clinique se heurte à plusieurs obstacles. Pour lever les freins, des chercheurs et chercheuses de l’Inserm, Université Sorbonne Paris Nord et Université Paris-Cité au sein du laboratoire IAME, en étroite collaboration avec des scientifiques de l’Institut Pasteur et de l’AP-HP, ont développé un modèle qui permet de mieux prédire l’efficacité de la phagothérapie. Il pourrait être utilisé pour mettre au point des essais cliniques plus robustes. Les résultats sont publiés dans la revue Cell Reports.
La découverte des antibiotiques a révolutionné l’histoire de la médecine au 20e siècle, permettant de lutter efficacement contre des bactéries pour lesquelles il n’y avait jusqu’alors pas de traitement. Cependant, l’antibiorésistance – phénomène durant lequel les bactéries deviennent résistantes aux antibiotiques suite à une utilisation massive et répétée de ces médicaments – est devenue un problème de santé publique majeur au cours des dernières décennies. On estime que ces bactéries résistantes sont responsables chaque année de 700 000 décès à travers le monde. Or, la découverte de nouveaux agents antibactériens stagne depuis plusieurs années.
Dans ce contexte, la phagothérapie a récemment suscité un regain d’intérêt. Cette approche thérapeutique se fonde sur l’utilisation de bactériophages qui ciblent et détruisent les bactéries pathogènes, mais sont incapables d’infecter l’être humain. Si le concept existe depuis longtemps, son développement clinique a été entravé par plusieurs limites.
Contrairement aux médicaments « classiques », les bactériophages sont des produits biologiques complexes, dont l’action dans l’organisme, la dose optimale ou la voie d’administration la plus efficace sont difficiles à étudier et à anticiper.
Afin de lever certains de ces obstacles, l’équipe de recherche menée par le chercheur Inserm Jérémie Guedj, en collaboration avec l’équipe de chercheurs de l’Institut Pasteur, dirigée par Laurent Debarbieux, a développé un nouveau modèle mathématique qui permet de mieux définir les interactions entre les bactériophages et la bactérie pathogène Escherichia coli chez l’animal et d’identifier les paramètres clés qui conditionnent l’efficacité de la phagothérapie.
Accompagner le développement clinique
Plusieurs données issues d’expériences in vitro et in vivo ont été utilisées pour construire ce modèle. Les chercheurs et chercheuses se sont notamment appuyés sur les paramètres d’infection des bactériophages déterminés au laboratoire (par exemple la durée du cycle infectieux des bactéries, le nombre de virus libérés quand une bactérie est détruite…) et sur des informations collectées lors d’expériences réalisées à l’aide d’un modèle d’infection pulmonaire chez la souris.
Une partie des animaux avait été infectée par une souche d’E. Coli bioluminescente (pour mieux la suivre dans l’organisme). Parmi eux, certains avaient été traités avec des bactériophages, selon différentes doses et voies d’administration. Les quantités de bactéries et de bactériophages ainsi mesurées au cours du temps ont permis d’alimenter le modèle mathématique et de tester quels étaient les paramètres les plus importants pour obtenir une phagothérapie efficace.
En utilisant leur modèle, les scientifiques montrent que la voie d’administration est un paramètre important à prendre en compte pour améliorer la survie des animaux : plus celle-ci permet une arrivée rapide des bactériophages au contact des bactéries, plus elle est efficace. Dans le modèle animal, la phagothérapie par voie intraveineuse était ainsi moins performante que la voie intra-trachéale car le nombre de bactériophages atteignant les poumons était plus faible. Par contre, par voie intra-trachéale, le modèle suggère que la dose de médicament donnée conditionne peu l’efficacité de cette thérapie.
Autre point important : cette modélisation intègre des données portant sur la réponse immunitaire des animaux, dans le contexte de la phagothérapie. Le modèle confirme et étend le principe que les bactériophages agissent en synergie avec le système immunitaire des animaux infectés, permettant une élimination plus efficace des bactéries pathogènes.
« Dans cette étude, nous proposons une nouvelle approche pour rationaliser le développement clinique de la phagothérapie, qui connait encore à l’heure actuelle des limites. Notre modèle pourrait être réutilisé pour prédire l’efficacité de n’importe quel bactériophage contre la bactérie qu’il cible, dès lors qu’un nombre limité de données in vitro et in vivo sont disponibles sur son action. Au-delà de la phagothérapie, le modèle pourrait aussi être utilisé pour tester des thérapies anti-infectieuses fondées sur l’association entre bactériophages et antibiotiques », conclut Jérémie Guedj.