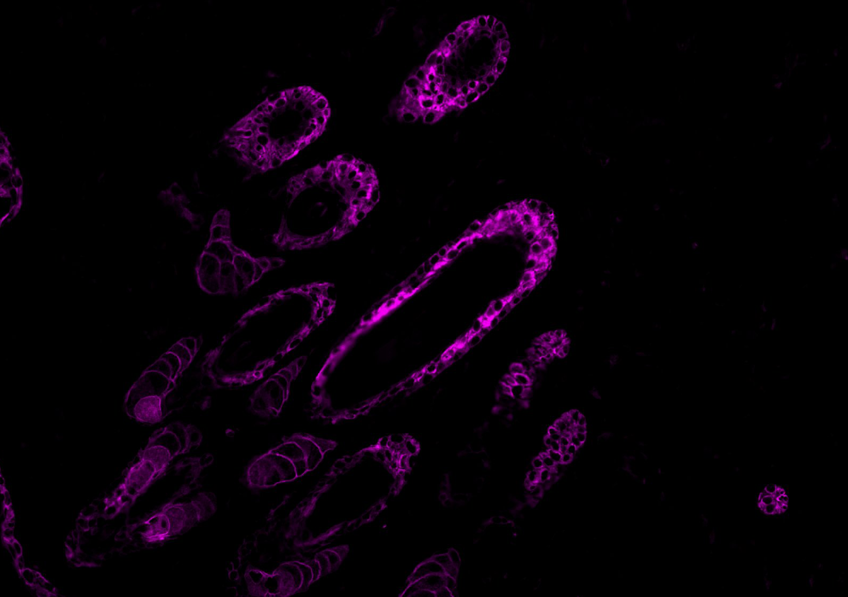
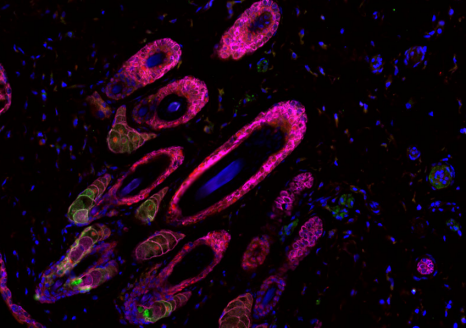
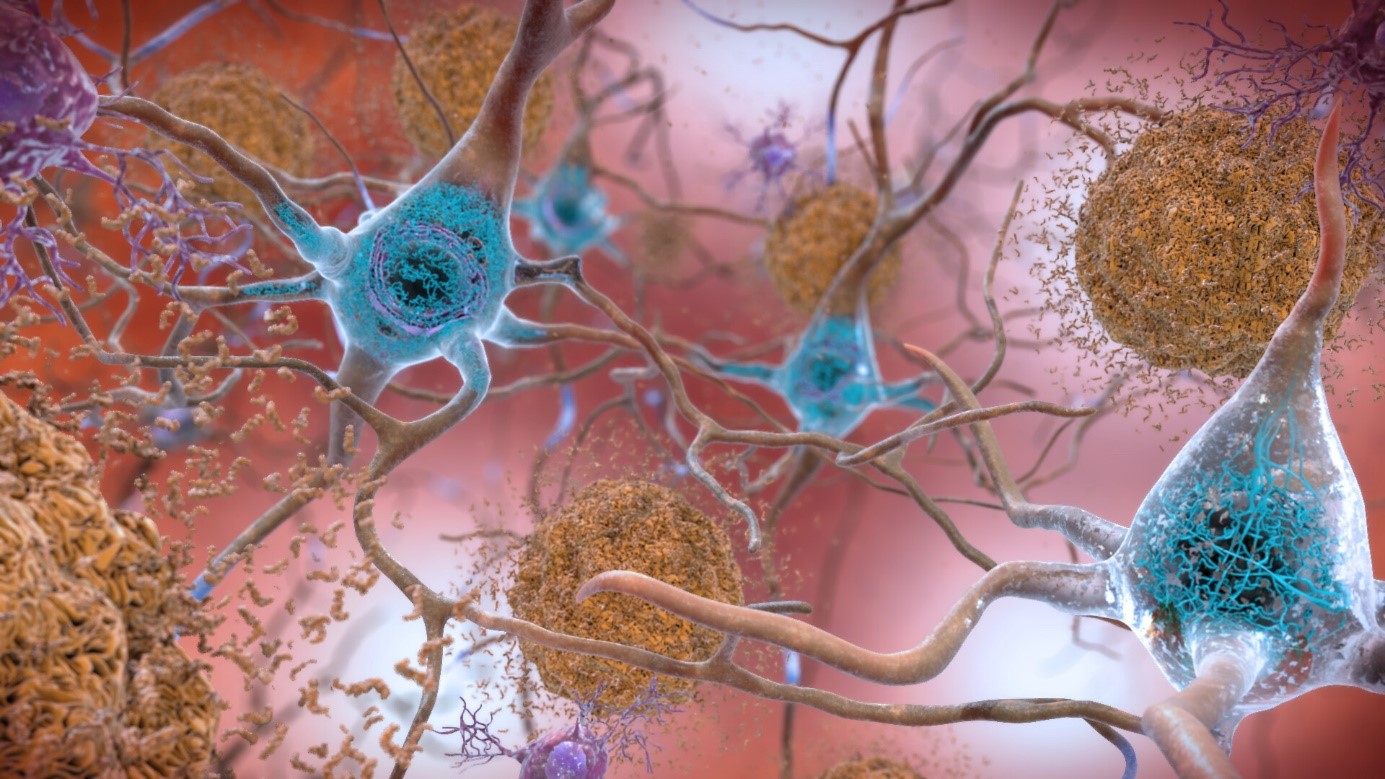
Dans la maladie d’Alzheimer, deux phénomènes pathologiques cérébraux ont déjà bien été documentés : l’accumulation de peptides béta-amyloïdes et la modification de Tau, une protéine, qui se retrouve sous la forme d’agrégats dans les neurones. © NIH/domaine public
L’identification des facteurs de risques génétiques de la maladie d’Alzheimer est un enjeu de recherche crucial pour mieux comprendre la pathologie et mieux la traiter. Les progrès de l’analyse du génome humain, couplés à la mise en place de grandes études d’associations pangénomiques[1] permettent aujourd’hui des avancées importantes dans le domaine. Des chercheurs et chercheuses de l’Inserm, de l’Institut Pasteur de Lille, du CHU de Lille et de l’Université de Lille au sein du laboratoire U1167 « Facteurs de risque et déterminant moléculaires des maladies liées au vieillissement » – en collaboration avec des équipes européennes, américaines et australiennes – ont ainsi identifié 75 régions du génome associées à la maladie d’Alzheimer. Parmi elles, 42 sont nouvelles, n’ayant encore jamais été impliquées dans la maladie. Les résultats, publiés dans la revue Nature Genetics, renforcent nos connaissances des mécanismes biologiques impliqués dans la pathologie et permettent d’envisager de nouvelles pistes de traitement et de diagnostic.
La maladie d’Alzheimer est la plus fréquente des démences, touchant environ 1 200 000 personnes en France. Il s’agit d’une pathologie multifactorielle complexe, qui apparaît généralement après 65 ans et pour laquelle il existe une forte composante génétique. La majorité des cas serait causée par l’interaction de différents facteurs de prédispositions génétiques avec des facteurs environnementaux.
Si la maladie est de mieux en mieux comprise, il n’existe pour l’heure aucun traitement permettant de la guérir. Les médicaments disponibles visent surtout à freiner le déclin cognitif et à réduire certains troubles du comportement.
L’un des enjeux majeurs de la recherche est de mieux caractériser les facteurs de risque génétiques de la maladie, pour mieux comprendre ses origines en identifiant les processus physiopathologiques impliqués
[2], et ainsi proposer de nouvelles cibles thérapeutiques.
Dans le cadre d’une collaboration internationale, des chercheurs et chercheuses de l’Inserm, de l’Institut Pasteur de Lille, du CHU de Lille et de l’Université de Lille ont mené une étude d’association pangénomique (en anglais genome-wide association study, GWAS) sur le plus grand groupe de patients Alzheimer mis en place jusqu’ici[3], sous la coordination du directeur de recherche Inserm Jean-Charles Lambert.
Favorisées par les progrès de l’analyse du génome, ces études consistent à analyser l’intégralité du génome de dizaines de milliers, voire de centaines de milliers d’individus, sains ou malades, pour identifier des facteurs de risques génétiques associés à des traits spécifiques de la maladie.
Avec cette méthode, les scientifiques ont ici pu identifier 75 régions du génome (appelées locus), associées à Alzheimer, dont 42 n’avaient jusqu’ici pas été impliquées dans cette maladie. « Après cette découverte importante, la suite de notre travail a consisté à caractériser ces régions du génome que nous avions identifiées pour leur donner du sens par rapport à nos connaissances biologiques et cliniques, et donc mieux comprendre les mécanismes cellulaires et les processus pathologiques à l’œuvre », souligne Jean-Charles Lambert.
Mise en lumière des phénomènes pathologiques
Dans la maladie d’Alzheimer, deux phénomènes pathologiques cérébraux ont déjà bien été documentés : l’accumulation de peptides béta-amyloïdes et la modification de Tau, une protéine, qui se retrouve sous la forme d’agrégats dans les neurones.
Les scientifiques ont ici confirmé l’importance de ces processus pathologiques. En effet, leurs analyses des différentes régions du génome confirment que certaines sont impliquées dans la production des peptides amyloïdes et dans le fonctionnement de la protéine Tau.
Par ailleurs, ces analyses révèlent aussi qu’un dysfonctionnement de l’immunité innée et de l’action de la microglie (cellule immunitaire présente dans le système nerveux central qui joue un rôle « d’éboueur » en éliminant les substances toxiques) est à l’œuvre dans la maladie d’Alzheimer.
Enfin, cette étude montre pour la première fois l’implication dans la maladie de la voie de signalisation dépendante du facteur de nécrose tumorale alpha (TNF-alpha)[4].
Ces résultats permettent de confirmer et de renforcer nos connaissances des processus pathologiques impliqués dans la maladie, et d’ouvrir de nouvelles voies pour la recherche thérapeutique. Ils confirment par exemple l’intérêt de mener des essais cliniques sur des traitements ciblant la protéine précurseur de l’amyloïde, de poursuivre les travaux sur les cellules microgliales, initiés il y a quelques années mais aussi de cibler la voie de signalisation du TNF-alpha.
Score de risque
En s’appuyant sur leurs résultats, les chercheurs ont également construit un score de risque génétique qui permet de mieux évaluer qui, parmi les personnes souffrant de troubles cognitifs, évoluera vers une maladie d’Alzheimer, dans les trois ans après la mise en évidence clinique des troubles. « Cet outil n’est pour le moment pas du tout destiné à la pratique clinique, mais il pourrait être très utile dans la mise en place d’essais thérapeutiques pour catégoriser les participants selon leur risque et mieux évaluer l’intérêt des médicaments testés », explique Jean-Charles Lambert.
L’équipe souhaite désormais poursuivre ses travaux dans un groupe encore plus large pour valider et étendre leurs résultats. Au-delà de cette caractérisation exhaustive des facteurs génétiques de la maladie d’Alzheimer, l’équipe développe par ailleurs de nombreuses approches de biologies cellulaires et moléculaires pour déterminer leurs rôles dans le développement de la maladie.
Par ailleurs, les recherches génétiques ayant pour le moment principalement été menées sur des populations d’origines caucasiennes, l’un des enjeux à venir sera de pratiquer le même type d’études dans d’autres groupes pour déterminer si les facteurs de risque sont les mêmes d’une population à une autre, ce qui renforcerait leurs importances dans le processus physiopathologique.
[1] En anglais, on parle de genome-wide association study, GWAS. Ces études consistent à analyser l’intégralité du génome de milliers voire de dizaines de milliers d’individus, sains ou malades, pour identifier des facteurs de risques génétiques associés à des traits spécifiques de la maladie.
[2] L’ensemble des problèmes fonctionnels engendrés par une maladie ou une affection particulière.
[3] Les chercheurs se sont ici intéressés aux données génétiques de 111,326 personnes ayant reçu un diagnostic de maladie d’Alzheimer ou ayant des proches atteints par la maladie et 677,663 « contrôles » sains. Ces données sont issues de plusieurs grandes cohortes européennes regroupées au sein du consortium European Alzheimer & Dementia BioBank (EADB).
[4] Le facteur de nécrose tumorale alpha est une cytokine, protéine du système immunitaire impliquée dans la cascade de l’inflammation, en particulier dans les mécanismes lésionnels tissulaires.