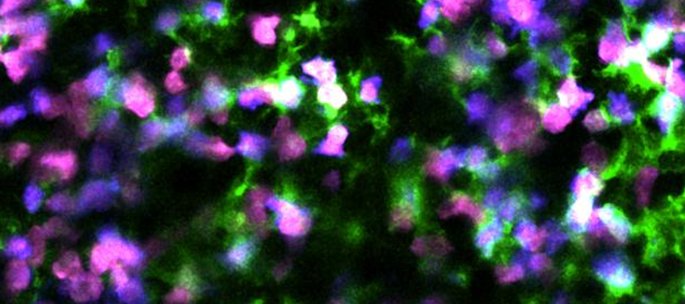
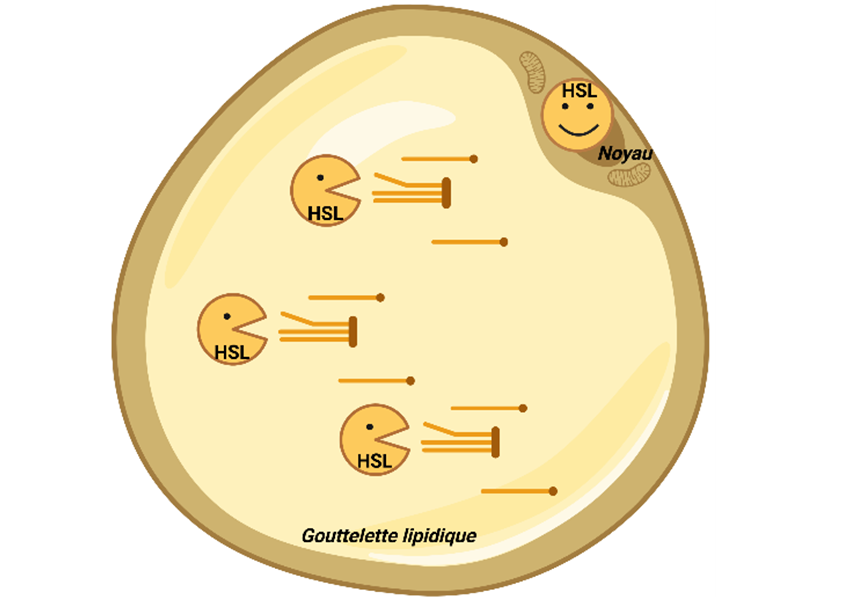
Rôles de la HSL dans les adipocytes. La HSL participe à la mobilisation des graisses stockées dans la gouttelette lipidique. Dans le noyau, elle assure le fonctionnement harmonieux de l’adipocyte. © I2MC, 2025. Créé avec biorender.com.
Rôles de la HSL dans les adipocytes. La HSL participe à la mobilisation des graisses stockées dans la gouttelette lipidique. Dans le noyau, elle assure le fonctionnement harmonieux de l’adipocyte. © I2MC, 2025. Créé avec biorender.com.
Depuis les années 1960, la lipase hormono-sensible (HSL) est connue comme l’enzyme qui permet d’accéder à l’énergie stockée dans nos graisses. On pourrait dès lors penser que son absence provoquerait une obésité avec un excès de masse grasse. Ce n’est pourtant pas le cas, c’est même l’inverse qui se produit. Une équipe de l’Université de Toulouse et de l’Inserm à l’Institut des maladies métaboliques et cardiovasculaires (I2MC) a résolu ce paradoxe en montrant que cette protéine agit également de façon inattendue dans le noyau de nos cellules graisseuses. Cette découverte, publiée dans Cell Metabolism le 23 octobre, ouvre de nouvelles pistes pour prévenir les complications liées à l’obésité.
Nos cellules graisseuses, appelées adipocytes, ne servent pas seulement à stocker des kilos en trop. Elles jouent un rôle clé dans la gestion de l’énergie de notre corps. Les adipocytes accumulent des graisses sous forme de gouttelettes lipidiques que l’organisme peut utiliser en cas de besoin, par exemple lors des périodes de jeûne entre les repas. Pour ce faire, il utilise la protéine HSL comme une sorte d’interrupteur. Quand le corps manque d’énergie, elle est activée par des hormones comme l’adrénaline et libère les graisses pour fournir du carburant à divers organes.
En l’absence de la protéine HSL, on pourrait supposer que le robinet à énergie est fermé et que les graisses vont inexorablement s’accumuler. Pourtant, de façon paradoxale, on constate chez la souris et chez des patients atteints de mutations du gène codant HSL que cela ne conduit pas à une obésité avec un excès de graisse. C’est l’opposé qui se produit : l’absence de cette protéine provoque une baisse de masse grasse, une condition pathologique nommée lipodystrophie.
Obésité et lipodystrophie, pourtant opposées en apparence, partagent un point commun : dans les deux cas, les adipocytes dysfonctionnent, entraînant des complications métaboliques et cardiovasculaires similaires.
Pour comprendre cette singularité, l’équipe scientifique menée par Dominique Langin, professeur à l’Université de Toulouse au sein de l’I2MC (Inserm/Université de Toulouse), a remarqué que HSL se situait dans une zone insoupçonnée jusque-là. Dans les adipocytes, la protéine est connue pour être en surface de la gouttelette lipidique où elle joue son rôle d’enzyme découpant les graisses, mais l’étude révèle qu’elle est aussi dans le noyau des cellules graisseuses.
« Dans le noyau des adipocytes, HSL est capable de s’associer avec de nombreuses autres protéines et de participer à un programme qui maintient une quantité optimale de tissu adipeux et des adipocytes ‘en bonne santé’ », précise Jérémy Dufau, co-auteur de l’étude et qui a soutenu sa thèse sur ce sujet.
De plus, l’étude montre que la quantité de HSL dans le noyau est finement contrôlée. L’adrénaline, qui permet l’activation de l’enzyme sur la gouttelette lipidique, favorise également sa sortie du noyau. C’est ce qui se passe lors du jeûne. Dans un contexte pathologique, la quantité de HSL du noyau est augmentée chez des souris obèses.
« HSL est connue depuis les années 1960 comme une enzyme de déstockage des graisses. Mais on sait désormais qu’elle joue aussi un rôle essentiel dans le noyau des adipocytes, où elle participe au maintien d’un tissu adipeux sain », conclut Dominique Langin.
Ce nouveau rôle pourrait expliquer la lipodystrophie des patients qui n’ont pas de HSL et ouvre des pistes pour mieux comprendre les maladies métaboliques telles que l’obésité et ses complications.
Cette découverte arrive à point nommé. Le surpoids et l’obésité touchent un adulte sur deux en France. Au niveau mondial, cela concerne 2 milliards et demi d’individus. L’obésité augmente le risque de nombreuses maladies dont le diabète et de maladies du cœur et affecte la qualité de vie. La poursuite des recherches est essentielle pour améliorer la prévention et la prise en charge des patients.
Cette étude s’inscrit dans le cadre du projet SPHERES, qui est un projet de 7 ans (2020-2027) financé par le Conseil européen de la recherche (ERC) dans le cadre du programme de recherche et d’innovation Horizon 2020 de l’Union européenne (accord de subvention N°856404).



 ©
© 


 © Adobe stock
© Adobe stock

 © Photo Jannis Brandt/ Unsplash
© Photo Jannis Brandt/ Unsplash