Parmi la population qui réside en France, 637 082 personnes sont décédées en 2023 sur le territoire, soit 36 000 décès de moins qu’en 2022. © Adobe Stock
Parmi la population qui réside en France, 637 082 personnes sont décédées en 2023 sur le territoire, soit 36 000 décès de moins qu’en 2022. © Adobe Stock
La Direction de la recherche, des études, de l’évaluation et des statistiques (DREES), le Centre d’épidémiologie des causes médicales de décès de l’Inserm (CépiDc-Inserm) et Santé Publique France analysent les causes médicales de décès des personnes résidentes et décédées en France en 2023.
Deux études complémentaires, qui présentent ces résultats, sont publiées conjointement dans le Bulletin épidémiologique hebdomadaire (Santé publique France) et dans un Études et Résultats (DREES). Elles s’appuient sur la statistique nationale des causes de décès produite par le CépiDc de l’Inserm à partir du recueil exhaustif et de l’analyse des volets médicaux des certificats de décès.
Parmi la population qui réside en France, 637 082 personnes sont décédées en 2023 sur le territoire, soit 36 000 décès de moins qu’en 2022. Le taux de mortalité standardisé, qui tient compte du vieillissement de la population, est de 828,3 décès pour 100 000 habitants. Il diminue de presque 60 décès pour 100 000 habitants par rapport à 2022 et atteint un niveau inférieur à celui de 2019. Ce niveau de mortalité, historiquement bas en 2023, est observé dans la grande majorité des pays européens. Pourtant, la mortalité en France reste supérieure à celle que l’on attendait si la tendance baissière observée au cours de la période 2015-2019 s’était prolongée jusqu’en 2023.
Une mortalité historiquement basse en 2023, portée en premier lieu par une baisse de la mortalité due à la Covid-19
Plus de 60% de la baisse de la mortalité en 2023 s’explique par celle de la mortalité due à la Covid-19. Des baisses de moindre ampleur s’observent aussi pour la majorité des grandes causes. À noter deux exceptions : la mortalité due à des maladies de l’appareil respiratoire et celle due à des maladies infectieuses et parasitaires sont en légère hausse.
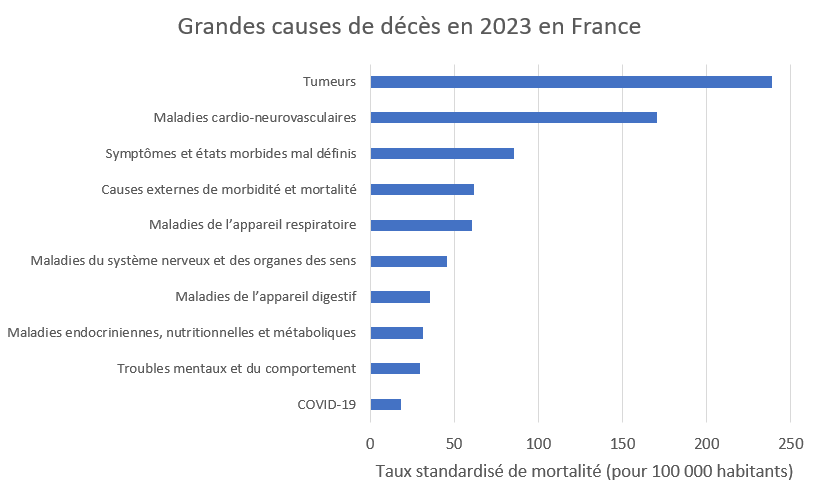
Les tumeurs, première cause de décès, chez les hommes comme chez les femmes, devant les maladies cardio-neurovasculaires
En 2023, les tumeurs, c’est-à-dire les cancers, première cause de décès, comptent pour plus d’un quart des décès (27%). Les décès dus aux tumeurs concernent des personnes en moyenne plus jeunes que ceux toutes causes confondues. La mortalité par tumeur continue de baisser, à l’exception de celle du pancréas en hausse tendancielle et celles du poumon, des bronches et de la trachée chez les femmes.
 En 2023, les tumeurs, première cause de décès, ont entraîné 239 décès pour 100 000 habitants en France (taux standardisé de mortalité). Hors symptômes et états morbides mal définis, le Covid-19 se place en 9e position.
En 2023, les tumeurs, première cause de décès, ont entraîné 239 décès pour 100 000 habitants en France (taux standardisé de mortalité). Hors symptômes et états morbides mal définis, le Covid-19 se place en 9e position.
Note : les causes externes de morbidité et mortalité regroupent les accidents, suicides, homicides, etc… Les symptômes et états morbides mal définis regroupent les causes inconnues et celles insuffisamment définies pour être classées dans un chapitre précis de la classification internationale des maladies.
Champ : Personnes décédées et résidant en France.
Source : Inserm-CépiDc
Les maladies cardio-neurovasculaires (comme par exemple l’infarctus du myocarde, l’accident vasculaire cérébral (AVC) et l’insuffisance cardiaque) ont, quant à elles, causé plus d’un cinquième des décès (21,4%). Elles restent la deuxième cause de mortalité, malgré un léger recul par rapport à l’année précédente.
En 2024, selon une première estimation encore provisoire les taux de mortalité associés à ces deux grandes causes de décès seraient en légère baisse. En revanche, le nombre de décès du fait de ces maladies serait lui en hausse, ou stable, porté par les effectifs des générations du baby-boom de plus en plus nombreux aux âges avancés.
Une mortalité plus élevée que les tendances pré-pandémiques pour certaines causes
En 2023, les taux de mortalité dus aux maladies cardio-neurovasculaires, aux maladies endocriniennes, nutritionnelles et métaboliques, aux maladies de l’appareil digestif, aux maladies génito-urinaires et aux causes externes (chutes accidentelles, accidents de la vie courante) restent plus élevés que ce que suggérait la prolongation de la tendance d’avant crise Covid-19.
Les tumeurs, deuxième cause de décès chez les enfants âgés de 1 à 14 ans
Chez les enfants de moins de 1 an, le taux de mortalité s’élève à 397,6 pour 100 000 enfants, et à 10,8 pour 100 000 chez les enfants âgés de 1 à 14 ans.
Plus de la moitié des décès d’enfants de moins de 1 an concerne une affection dont l’origine se situe dans la période périnatale et près d’un sur cinq est dû à une malformation congénitale ou une anomalie chromosomique.
Les deux premières causes de décès des enfants âgés de 1 à 14 ans sont d’abord les causes externes (30 % des décès) dont les trois-quarts sont des accidents de la vie courante et de transport ; et ensuite les tumeurs (17 % des décès).
Une mortalité plus élevée dans les DROM, le nord et l’est de la France métropolitaine
Le nombre de décès est plus élevé qu’attendu dans les départements et régions d’outre-mer (DROM), si les conditions de mortalité étaient les mêmes que pour la France entière en 2023, notamment à Mayotte (+89 %) et en Guyane (+37%). C’est aussi le cas dans une moindre mesure dans le nord et l’est de la France métropolitaine avec notamment (+17% dans les Hauts-de-France). En revanche, il est sensiblement plus faible en Île-de-France (-15% par rapport à la moyenne nationale).
Ces disparités territoriales sont plus marquées pour les maladies cardio-neurovasculaires que pour les tumeurs.
En particulier, on décède davantage de maladies cardio-neurovasculaires et moins de tumeurs dans les DROM qu’en France métropolitaine (sauf à Mayotte).
De fortes disparités régionales et départementales s’observent aussi pour les maladies infectieuses, endocriniennes, respiratoires, et la Covid-19. Au contraire, on décède autant de maladies du système nerveux dans chaque région.
Des différences notables de causes de mortalité selon les lieux de vie
La mortalité est par ailleurs plus importante dans les territoires ruraux hors d’influence des villes, et plus faible au sein des pôles des grandes agglomérations, notamment pour les maladies cardio-neurovasculaires et les causes externes.
En outre, les décès dus aux maladies endocriniennes, aux troubles mentaux, aux maladies du système nerveux, ou encore aux maladies du système digestif sont plus élevés dans les zones rurales loin des villes et dans les pôles urbains de moins de 700 000 habitants. Notamment, certaines causes de décès, dont une partie pourrait être évitée par la prévention, provoquent davantage de décès dans les pôles urbains peu denses et isolés.
Près d’un quart des décès ont lieu à domicile, dont 30% en hospitalisation à domicile
Plus de la moitié des décès (53%) ont lieu en établissement de santé (public ou privé) et quasiment un quart à domicile (24%), des proportions comparables à 2022. Près de 30% des décès à domicile concernent des personnes en hospitalisation à domicile (HAD), une proportion en hausse par rapport à 2022.
Deux études complémentaires, pour mieux documenter les causes de décès en 2023 et leurs évolutions
L’article du BEH analyse les grandes causes de décès en 2023 et leurs évolutions en comparaison à la période 2015-2019 et depuis 2020. La publication Études et Résultats détaille, quant à elle, les disparités territoriales de la mortalité par cause en 2023. Enfin, elle présente une première estimation des causes de décès en 2024.
 Images représentatives de tissu adipeux omental (graisse abdominale profonde) provenant de personnes atteintes d’obésité, observées en lumière blanche et en lumière polarisée. Les coupes histologiques ont été colorées au rouge picrosirius, un colorant qui permet de révéler les zones de fibrose, visibles autour des adipocytes (cellules graisseuses) ou à la surface de lobules graisseux. © Geneviève Marcelin
Images représentatives de tissu adipeux omental (graisse abdominale profonde) provenant de personnes atteintes d’obésité, observées en lumière blanche et en lumière polarisée. Les coupes histologiques ont été colorées au rouge picrosirius, un colorant qui permet de révéler les zones de fibrose, visibles autour des adipocytes (cellules graisseuses) ou à la surface de lobules graisseux. © Geneviève Marcelin

 Visualisation en microscopie de fibroblastes de peau humaine © AdobeStock
Visualisation en microscopie de fibroblastes de peau humaine © AdobeStock