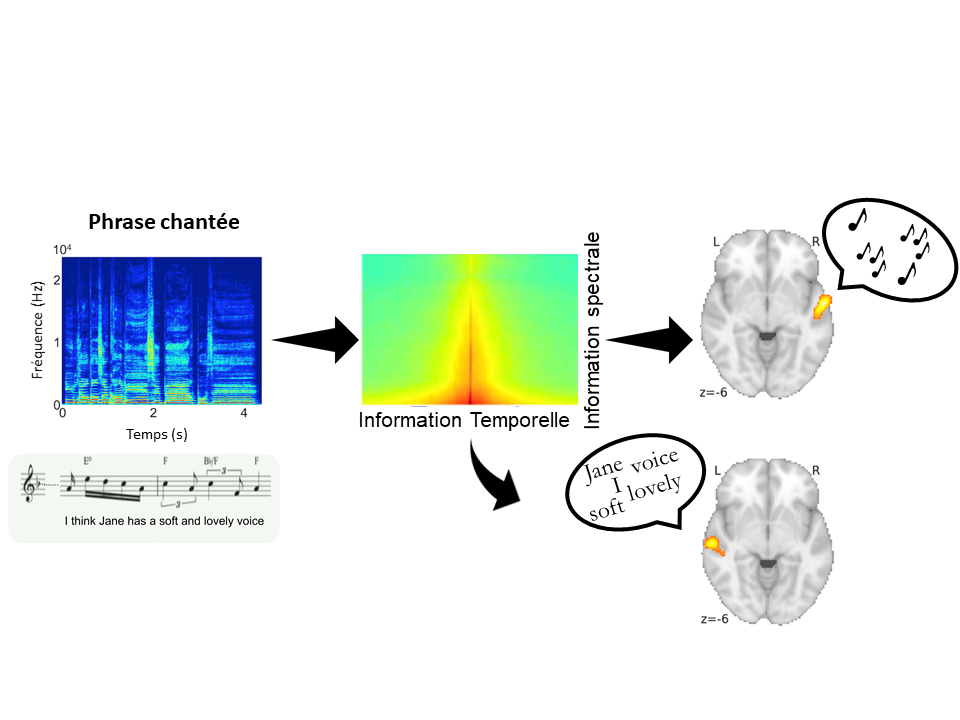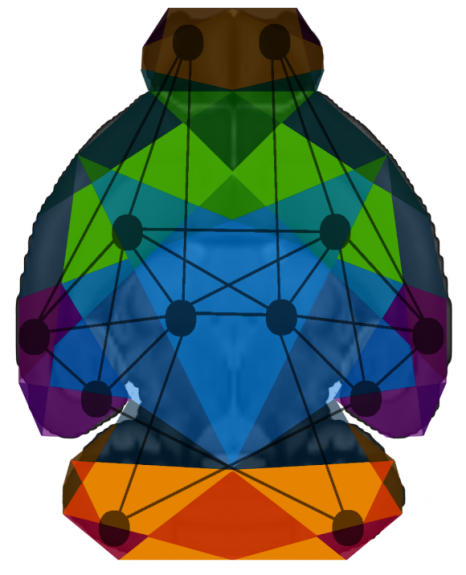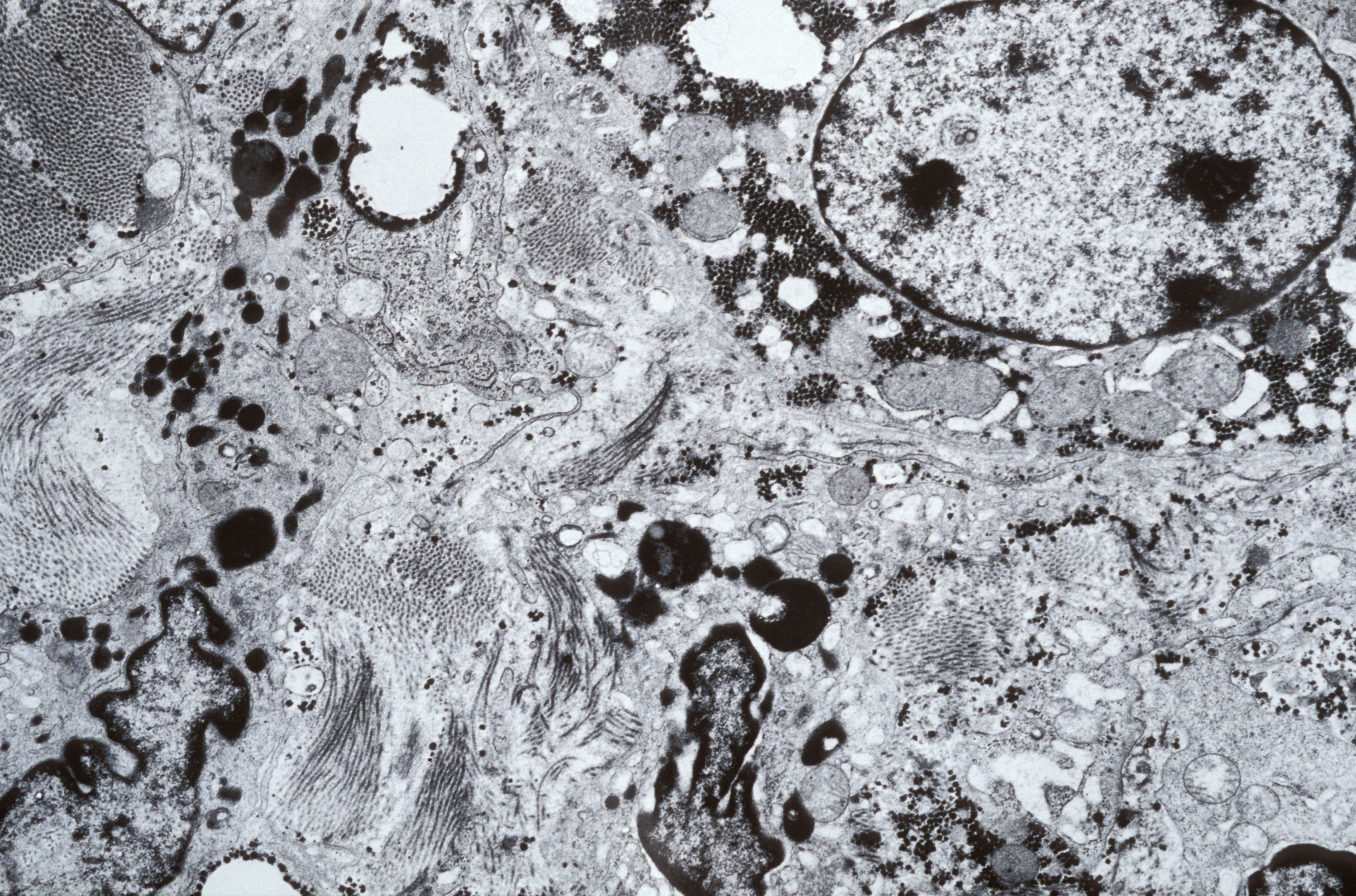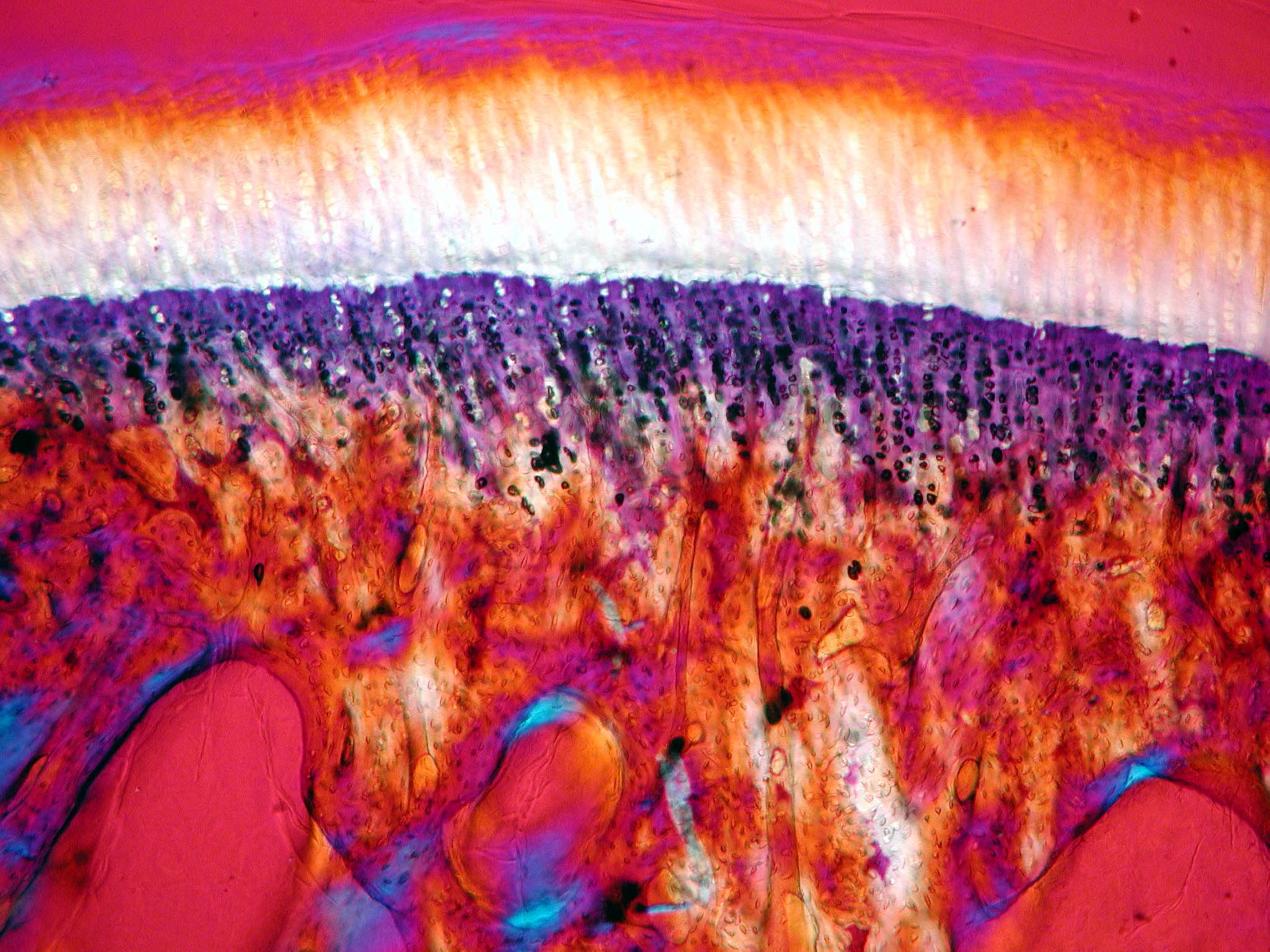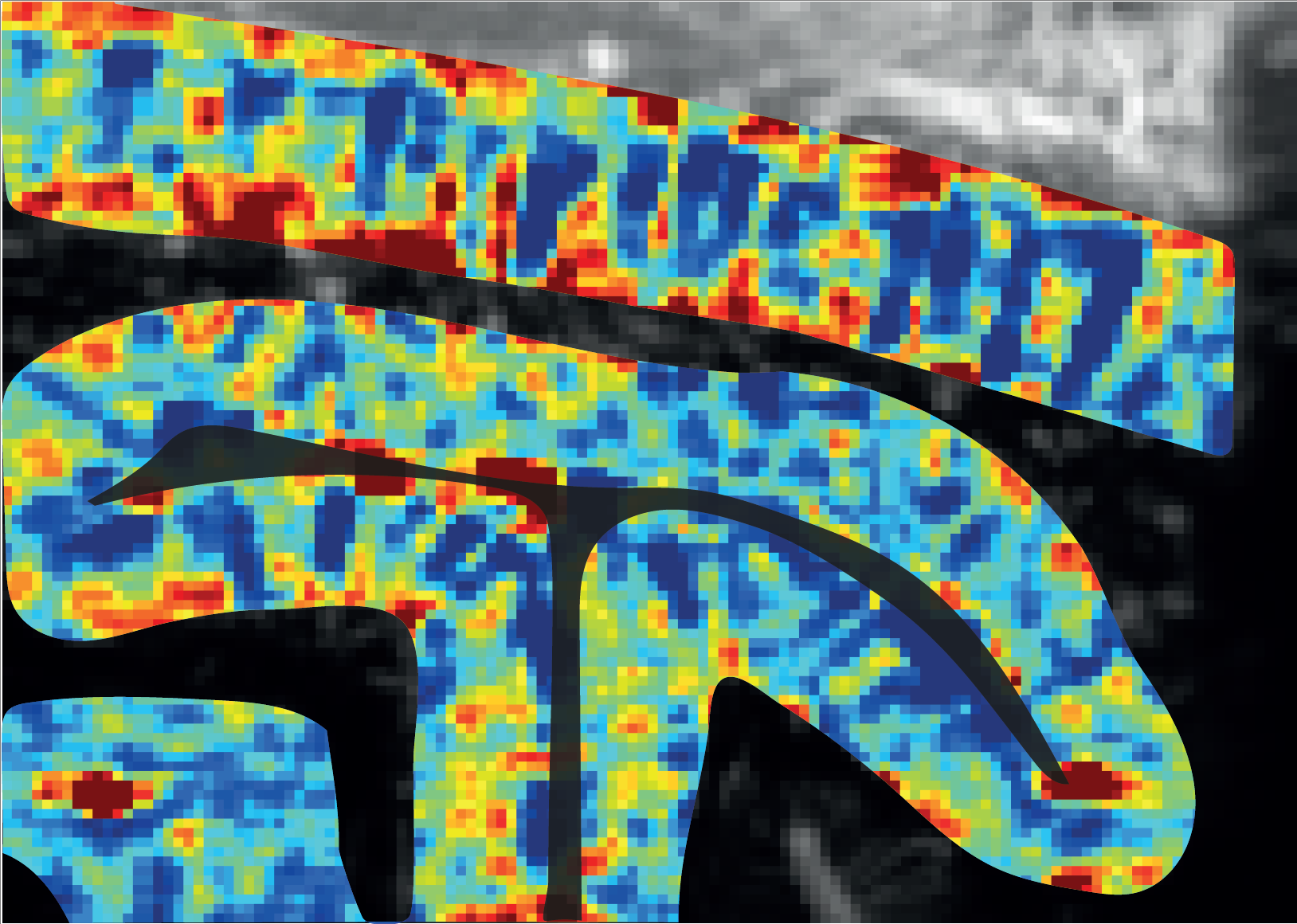
Colonnes de dominance oculaire dans le cortex visuel du primate non-humain après visualisation par imagerie ultrasonore ultrarapide. ©Kevin Blaize, Institut de la vision, Paris, France
L’imagerie ultrasonore ultrarapide a récemment été proposée pour suivre l’activité cérébrale dans la profondeur du cerveau. Cette nouvelle technologie permettrait même de visualiser des structures fonctionnelles aussi fines – que les colonnes corticales du cortex visuel – d’une taille trop petite pour une détection plus traditionnelle par imagerie par résonnance magnétique (IRM). Telles sont les conclusions d’une étude dirigée par Serge Picaud, physiopathologiste à l’Institut de la vision (Sorbonne Université / Inserm / CNRS) et Mickael Tanter, physicien au laboratoire Physique pour la médecine (ESPCI Paris – PSL / Inserm / CNRS) et directeur de l’ART « Ultrasons biomédicaux ». Les répercussions de leurs travaux, parus le 8 juin 2020 dans la revue PNAS, s’étendent bien au-delà de la compréhension du système visuel.
Le fonctionnement du cerveau demeure difficile à comprendre car l’IRM requiert des équipements lourds non mobiles souvent incompatibles à la réalisation de tâches comportementales. Par ailleurs, les technologies optiques ont offert une très haute résolution mais uniquement pour observer les structures à la surface du cerveau mis à nu.
À l’inverse, comme le souligne cette nouvelle étude parue dans PNAS, l’imagerie ultrasonore ultrarapide permet de visualiser les structures fonctionnelles profondes dans le cortex visuel sur un animal éveillé réalisant une tâche de comportement.
En une heure, la projection du champ visuel sur le cortex peut être reconstruite et ce, même dans la profondeur du cortex visuel. La répartition différentielle des informations de l’œil gauche et de l’œil droit sous forme de colonnes de dominance oculaire apparait sur les images malgré leur taille de quelques centaines de microns. Il devient même possible de distinguer l’extension de ces colonnes dans les différentes couches du cortex visuel et donc la zone d’intégration des informations visuelles provenant de chacun des deux yeux, ce que seule l’histologie sur coupes de cerveau avait permis de visualiser.Si auparavant, une telle visualisation des couches du cortex n’avait pu être réalisée autrement que par histologie, un partenariat pluridisciplinaire mettant en commun les connaissances sur le système visuel[1], le cerveau[2] et l’imagerie ultrasonore ultrarapide[3] l’a rendue possible. Ce partenariat pluridisciplinaire s’inscrivait dans le cadre du projet Européen ERC Synergy « Helmholtz » pour le développement de technologies d’investigation du système visuel.
En révélant ainsi les structures fonctionnelles dans la profondeur du cortex visuel, les chercheurs ouvrent un nouveau champ d’investigation pour la compréhension de notre vision et plus largement du cerveau.
Ces travaux mettent en lumière combien l’imagerie ultrasonore ultrarapide pourrait changer l’analyse du fonctionnement du cerveau en révélant des structures fonctionnelles de taille autrefois impossibles à discerner.
[1] Institut de vision (Sorbonne Université / Inserm / CNRS)
[2] Institut du cerveau (Sorbonne Université / Inserm / CNRS) et Institut de neurosciences de la Timone (CNRS / AMU)
[3] laboratoire Physique pour la médecine (ESPCI Paris – PSL / Inserm / CNRS) et Institut Langevin (ESPCI Paris – PSL / CNRS)