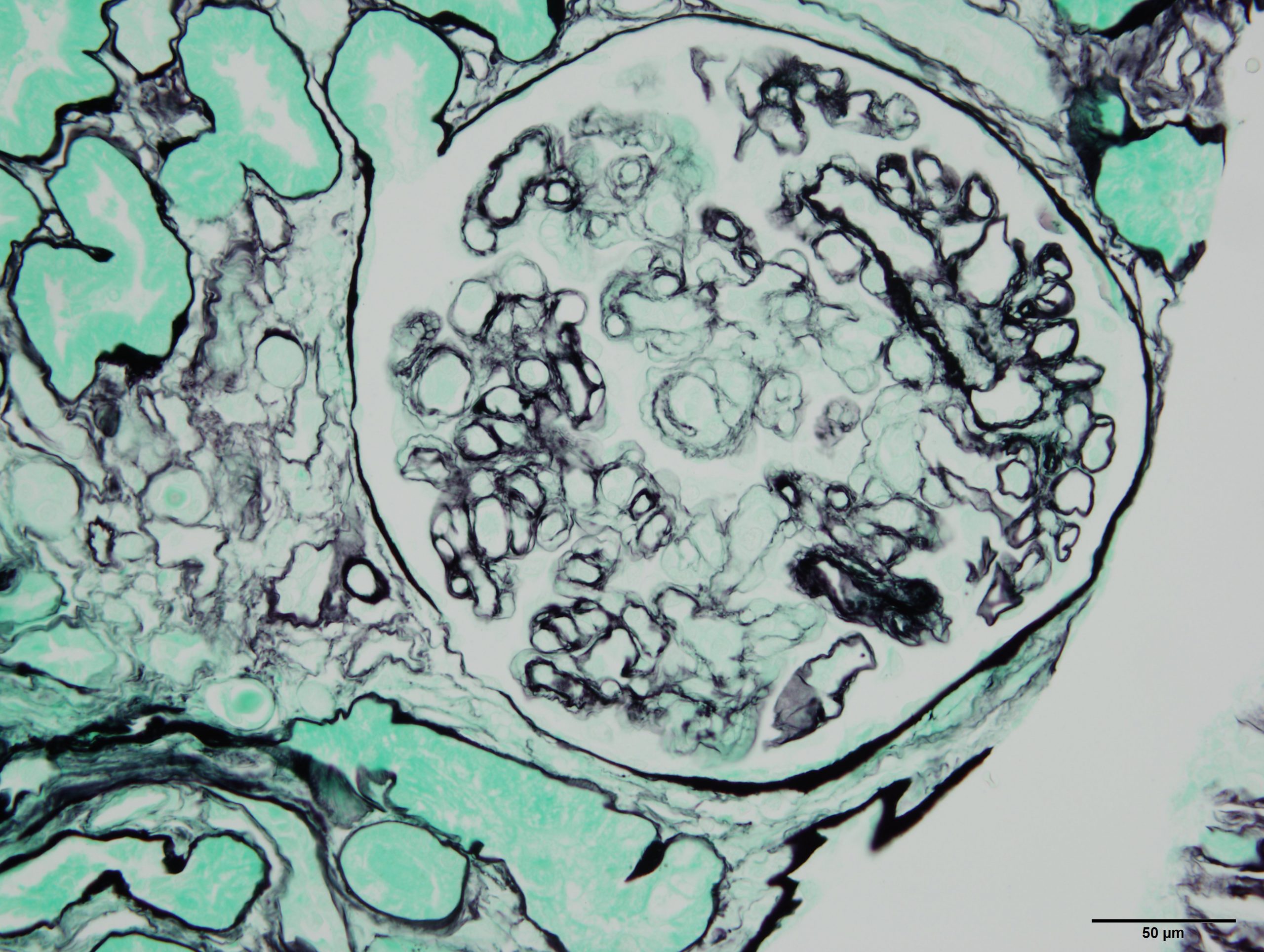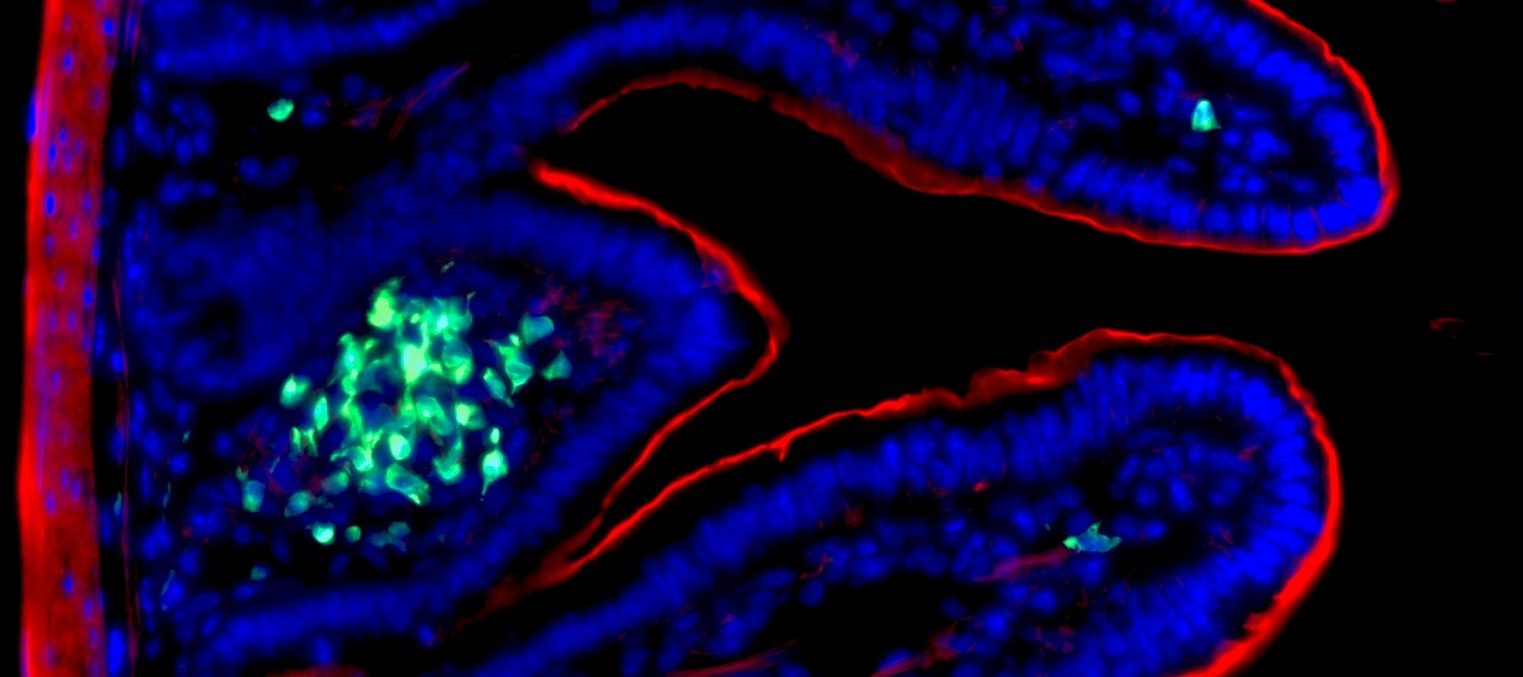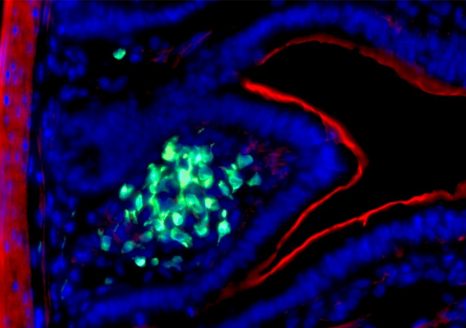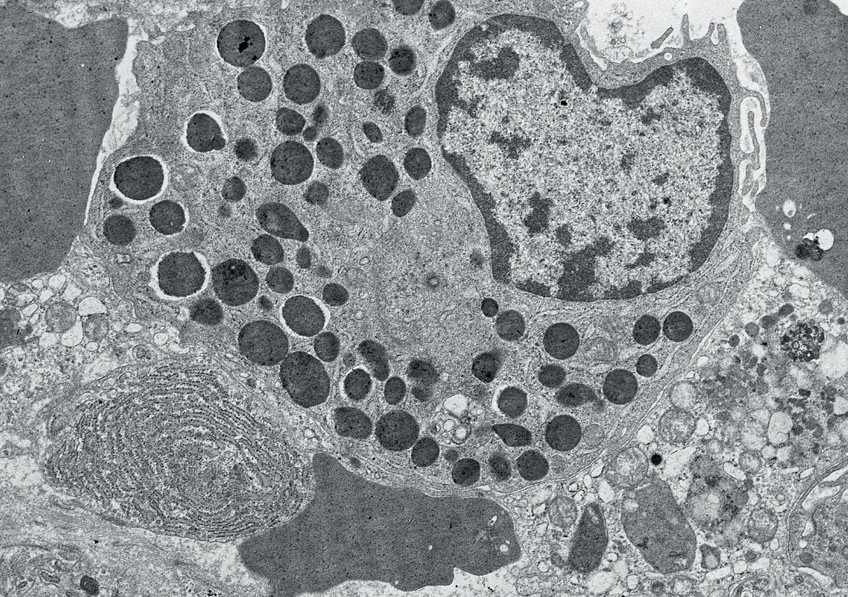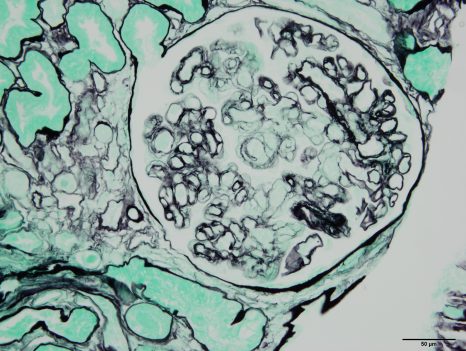
Image histologique d’un rejet de greffe rénale médié par des anticorps. Sophie Caillard/Jérome Olagne (Inserm U1109)
La greffe de rein est l’unique traitement curatif pour les personnes souffrant d’insuffisance rénale terminale, mais cette intervention n’est pas toujours un succès car le greffon peut être rejeté par l’organisme du patient. Afin de diminuer le risque de rejet, les médecins peuvent aujourd’hui s’intéresser à un certain nombre de paramètres génétiques et immunologiques pour évaluer l’histocompatibilité entre donneur et receveur, c’est-à-dire le degré de compatibilité de leurs organes et de leurs tissus. Toutefois, les rejets sont toujours fréquents et beaucoup demeurent inexpliqués. Dans une nouvelle étude, des chercheurs et chercheuses de l’Inserm, de l’Université de Strasbourg et des Hôpitaux Universitaires de Strasbourg au sein de l’unité U1109 « Immunologie et Rhumatologie Moléculaire », et leurs partenaires du Laboratoire d’Excellence (LabEx) Transplantex, rapportent que le gène MICA est un nouveau gène d’histocompatibilité, c’est à dire qu’il permet de mieux expliquer et prédire le succès ou l’échec d’une greffe de rein. Les résultats sont publiés dans la revue Nature Medicine.
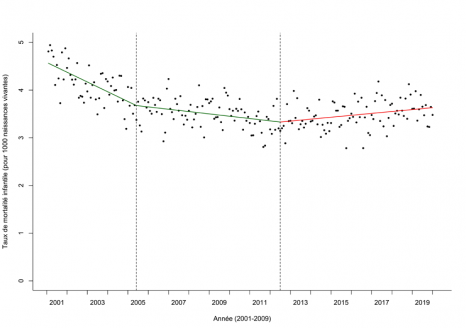
La greffe de rein est aujourd’hui le meilleur traitement disponible pour les patients atteints d’insuffisance rénale terminale. En France, près de 4000 greffes rénales sont effectuées en moyenne chaque année (près de 20000 aux Etats-Unis). Ces greffes sont principalement réalisées à partir de donneurs décédés, même si le nombre de greffes à partir de donneurs vivants augmente progressivement chaque année depuis vingt ans.
La possibilité de rejet du greffon considéré comme « étranger » par l’organisme du receveur demeure aujourd’hui la limite principale de cette procédure. La prise de médicaments immunosuppresseurs[1] permet de réduire le risque mais ne l’élimine pas et le rejet dit « chronique » (à distance de l’acte chirurgical de la greffe) reste une problématique majeure.
La découverte du système HLA par le chercheur français Jean Dausset et ses collègues au milieu du XXe siècle a permis des avancées importantes. Il s’agit d’un ensemble de protéines codées par les gènes HLA, qui sont présentes à la surface de nos cellules notamment des globules blancs.
Très diversifié et spécifique à chaque individu, ce système permet d’évaluer l’histocompatibilité entre donneur et receveur, c’est-à-dire le degré de compatibilité de leurs organes et de leurs tissus. Plus les gènes HLA entre donneurs et receveurs sont proches, plus le risque de rejet est diminué.
Cependant, il arrive que même lorsque les gènes HLA du donneur et du receveur sont compatibles, des rejets de greffes inexpliqués surviennent. Ce phénomène suggère que d’autres gènes d’histocompatibilité non encore identifiés peuvent être impliqués dans les rejets.
Un rôle pour le gène MICA
Des chercheurs et chercheuses de l’Inserm, de l’université de Strasbourg et des Hôpitaux Universitaires de Strasbourg et leurs partenaires du LabEx Transplantex se sont donc intéressés à un gène découvert il y a déjà presque trente ans par Seiamak Bahram[2] qui a coordonné ces nouveaux travaux.
Ce gène, appelé MICA, code pour une protéine exprimée sur plusieurs types de cellules. De précédentes études avaient déjà suggéré que ce gène était important pour prédire le devenir d’une greffe, mais elles portaient sur un nombre trop restreint de patients (entre autres limites méthodologiques) pour pouvoir affirmer qu’il s’agissait d’un gène d’histocompatibilité. Par ailleurs ces études ne s’intéressaient pas au système MICA dans son ensemble, c’est-à-dire à la fois à la génétique (histocompatibilité) et aux aspects sérologiques (présence d’anticorps anti-MICA dans le sang du receveur).
L’équipe a ici étudié le gène MICA chez plus de 1500 patients ayant reçu une greffe de rein ainsi que chez leurs donneurs. Les analyses de séquences du gène MICA révèlent que lorsque receveur et donneur présentent une version différente du gène, la survie du greffon est diminuée.
Par ailleurs, les chercheurs et chercheuses montrent que ces incompatibilités du gène MICA sont à l’origine chez les patients de la synthèse d’anticorps dirigés contre les protéines MICA du donneur, qui interviennent dans le rejet de greffe. Ces anticorps sont produits lorsque les protéines MICA du donneur sont trop différentes de celles du receveur.
Ces résultats suggèrent que le gène MICA serait un gène d’histocompatibilité pertinent à prendre en compte au moment d’une greffe, et que la recherche d’anticorps anti-MICA peut également être intéressante pour prédire le succès ou l’échec de la greffe. Ils doivent maintenant être validés dans le cadre de larges études prospectives dans laquelle MICA sera considéré au même titre que les gènes HLA classiques.
« Suite à ce travail, on pourrait d’ores et déjà envisager de généraliser en clinique le séquençage du gène MICA et l’identification d’anticorps anti-MICA chez les patients avant la greffe pour évaluer l’histocompatibilité avec le donneur et après la greffe pour mieux prévenir les épisodes de rejets. Enfin, nous envisageons aussi d’étudier le rôle du gène MICA dans la greffe d’autres organes solides, notamment le cœur, le poumon ou encore le foie », souligne Seiamak Bahram.
[1] Traitements qui limitent l’action du système immunitaire utilisés pour les maladies auto-immunes ou en cas de greffe.
[2] Professeur des Université-Praticien Hospitalier et directeur de l’Unité 1109 de l’Inserm et du LabEx Transplantex et chef de service d’immunologie biologique aux HUS.