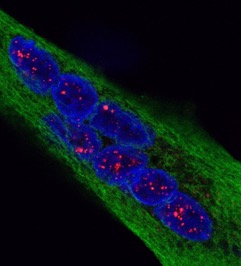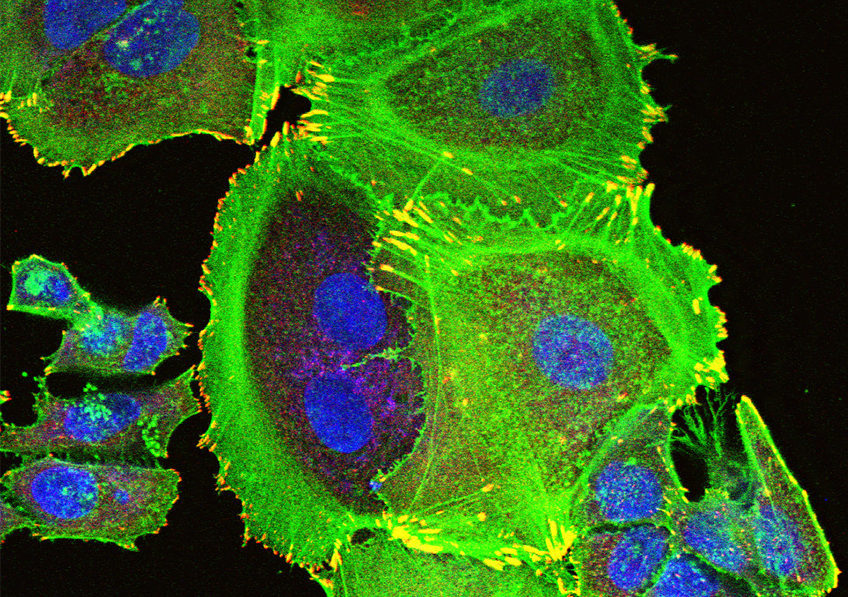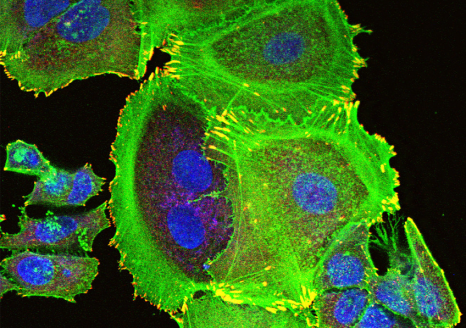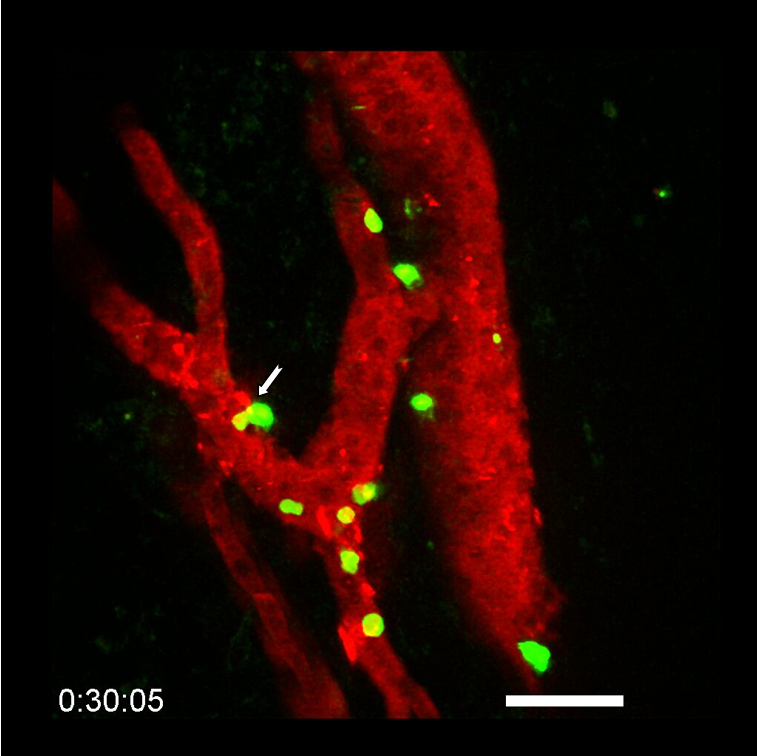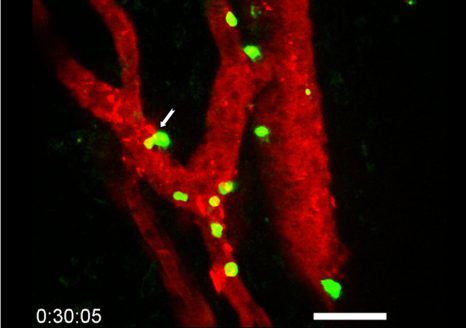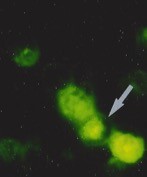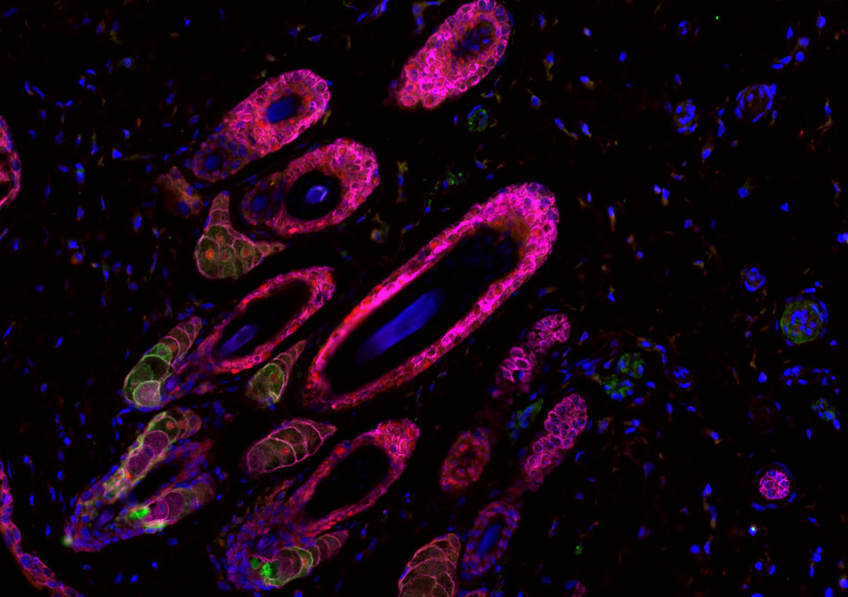
Visualisation en microscopie d’une cellule cancéreuse (noyau en bleu) traitée avec des protéines de fusion bi-modulaires (BMFPs) sur lesquelles se fixent des anticorps anti-EBV (en vert). © Jean-Philippe Semblat et Arnaud Chêne – UMR1134 (Inserm/Université de Paris)
La thérapie par anticorps monoclonaux peut s’avérer très efficace dans le traitement de nombreuses maladies comme les cancers, les maladies inflammatoires chroniques ainsi que certaines maladies d’origine infectieuse. Cependant, il s’agit d’un traitement coûteux fondé sur l’utilisation de molécules compliquées à produire. Identifier de nouvelles alternatives thérapeutiques est donc essentiel pour permettre au plus grand nombre de patients d’accéder aux traitements dont ils ont besoin. A cette fin, des chercheurs et chercheuses de l’Inserm, d’Université de Paris, de Sorbonne Université et du CNRS[1] ont conçu et testé une nouvelle approche d’immunothérapie reposant sur l’utilisation d’anticorps préexistants dirigés contre le virus d’Epstein-Barr (de la famille des virus de l’herpès), présents chez plus de 95 % de la population mondiale, pour cibler et détruire des cellules pathogéniques (responsables de maladies). Les résultats viennent d’être publiés dans une étude dans la revue Science Advances.
Les anticorps monoclonaux ont permis des avancées thérapeutiques majeures dans de nombreux domaines de la médecine. En France, plusieurs dizaines d’anticorps monoclonaux sont commercialisés aujourd’hui pour le traitement de cancers, de maladies inflammatoires chroniques (polyarthrite rhumatoïde, sclérose en plaques, psoriasis, …) ou pour prévenir les rejets de greffe.
Produits pour la plupart d’entre eux dans des cellules de mammifères, ces médicaments demeurent toutefois complexes à développer et coûteux à fabriquer. En conséquence, l’accès à ces thérapies est encore restreint pour de nombreux patients dans de nombreux pays. Afin de proposer de nouvelles solutions thérapeutiques qui pourraient compléter les traitements existants ou offrir de nouvelles possibilités thérapeutiques pour des maladies pour lesquelles il n’en existe pas encore, des scientifiques de l’Inserm, du CNRS, de Sorbonne Université et d’Université de Paris ont conçu une nouvelle approche d’immunothérapie.
Le principe est de rediriger une réponse immunitaire préexistante contre le virus d’Epstein-Barr (EBV) vers des cellules cibles que l’on cherche à détruire. Le virus d’Epstein-Barr – qui appartient à la famille des virus de l’herpès – est transmissible principalement par la salive et touche plus de 95 % de la population mondiale.
La grande majorité des personnes ne présente pas de symptômes et le virus a la capacité de persister de façon chronique chez les personnes infectées, sous le contrôle efficace du système immunitaire. En conséquence, des anticorps anti-EBV circulent chez ces personnes durant toute leur vie.
Développer un outil thérapeutique fondé sur le recrutement de ces anticorps anti-EBV déjà présents chez les patients présente un intérêt majeur pour réorienter cette réponse immunitaire contre des cellules cibles prédéfinies en fonction de la maladie à soigner. Cette immunothérapie pourrait être applicable chez un très grand nombre de patients du fait de la présence des anticorps anti-EBV chez quasiment tous les individus.
Un nouveau système prometteur
Les chercheurs et chercheuses ont conçu des protéines particulières, dites protéines de fusion bi-modulaires (BMFPs). Celles-ci sont composées d’un domaine qui va se fixer spécifiquement à un antigène exprimé à la surface de la cellule cible que l’on cherche à détruire. Ce domaine est par ailleurs fusionné à l’antigène EBV-P18 du virus Epstein-Barr contre lequel des anticorps de type IgG[2] sont déjà présents chez le patient. Le recrutement de ces anticorps à la surface des cellules cibles traitées avec les BMFPs va alors activer les défenses immunitaires de l’organisme. Cela aboutira à la destruction des cellules ciblées.
Les chercheurs et chercheuses ont d’abord testé ce système in vitro en utilisant plusieurs cellules cibles et ont montré qu’il permettait de déclencher efficacement différents mécanismes du système immunitaire capables d’éliminer les cellules ciblées.
Les BMFPs ont ensuite été façonnées pour cibler un antigène exprimé à la surface de cellules tumorales et ont été testées dans un modèle animal de cancer. Les résultats sont prometteurs puisque le traitement a conduit à une augmentation significative de la survie ainsi qu’à une rémission totale du cancer chez certains animaux.
« Ces résultats positionnent les BMFPs comme de nouvelles molécules thérapeutiques qui pourraient s’avérer utiles dans le traitement de multiples maladies. En effet, il s’agit d’un système très versatile, puisque l’on peut aisément changer le module de liaison et donc l’antigène ciblé pour adapter le traitement à de nombreuses maladies, dans le domaine du cancer, de l’infectiologie mais aussi des maladies auto-immunes », explique Arnaud Chêne, chargé de recherche Inserm et dernier auteur de l’étude.
« Les BMFPs sont bien plus faciles et rapides à produire que les anticorps monoclonaux entiers, sans avoir recours à une ingénierie sophistiquée pour optimiser leurs fonctions, ce qui permettra de réduire les coûts et d’ouvrir l’accès à ces thérapies à un plus large spectre de patients », ajoute Jean-Luc Teillaud, directeur de recherche émérite à l’Inserm.
« En attendant de pouvoir mettre sur pied des essais cliniques contre diverses maladies, allant du cancer au paludisme, la technologie a d’ores et déjà donné lieu aux dépôts de deux brevets. » précise Benoît Gamain, directeur de recherche au CNRS.
[1] Deux laboratoires ont été impliqués dans ces travaux : « Biologie intégrée du globule rouge » (U1134 Inserm/Université de Paris) et « Centre d’immunologie et des maladies infectieuses » (U1135 Inserm/Sorbonne Université/CNRS).
[2] Les IgG représentent le principal type d’anticorps trouvé dans le sang et participent à la réponse immunitaire secondaire.