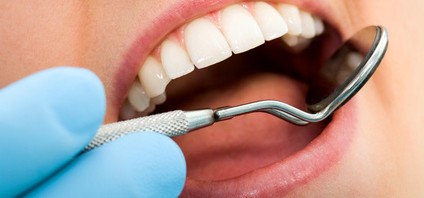
Dans un avenir proche, détecter un cancer sera peut-être possible par une simple analyse de sang ou d’urine. En effet, des biologistes du CNRS, de l’Inserm et des universités Paris Descartes et de Strasbourg viennent de mettre au point une technique capable de déceler les infimes traces d’ADN tumoral présentes dans les fluides biologiques de patients atteints d’un cancer. La méthode consiste à réaliser des analyses moléculaires ultra-sensibles dans des gouttelettes microscopiques. Testée avec succès sur des gènes impliqués dans différents cancers dont le cancer du côlon ou la leucémie, elle a le potentiel pour devenir une aide majeure pour les oncologues dans l’établissement du diagnostic comme dans l’élaboration du traitement. Une étude clinique est d’ores et déjà envisagée pour évaluer cette méthode. Ces travaux viennent d’être publiés sur le site de la revue Lab on a chip.
Lorsque les cellules tumorales meurent, elles déversent leur contenu dans le milieu extracellulaire. Ce contenu, en particulier l’ADN des cellules, se retrouve ensuite dans les liquides biologiques du patient : le sang, la lymphe, l’urine… Comme le développement de la plupart des cancers fait intervenir des facteurs génétiques, une simple analyse de sang ou d’urine pourrait en théorie révéler la présence d’ADN tumoral et donc d’un cancer. Et ce, dès la mort des premières cellules cancéreuses, donc à un stade très précoce.
Malgré ces belles promesses, il y a un hic qui explique pourquoi les médecins ne peuvent encore traquer les cancers dans les fluides biologiques : l’ADN tumoral n’y est présent qu’à l’état de traces. Dans le sang, par exemple, il représente moins de 0,01% de tout l’ADN qui s’y trouve sous forme diluée. Or les méthodes d’analyse classiques d’ADN ne sont pas assez sensibles pour détecter de si faibles quantités. C’est tout l’intérêt de la technique qu’ont développée des chercheurs du CNRS, de l’Inserm, de l’université de Strasbourg et de l’université Paris Descartes, en collaboration avec une équipe allemande du Max Planck institute (Göttingen) et une société américaine (Raindance Technologies). Déceler des seuils d’ADN 20 000 fois inférieurs à ce qui se faisait avant en clinique, telle est la prouesse réalisée par cette technique.
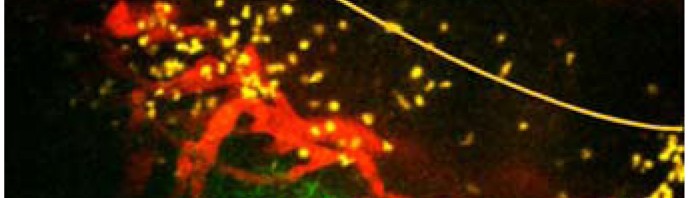
Comment fonctionne-t-elle ? Une première étape consiste à répartir l’ADN extrait d’un échantillon biologique dans des millions de gouttelettes suffisamment petites pour que chacune ne contienne qu’un seul gène cible. Puis, cet ADN est amplifié grâce à des méthodes de multiplication moléculaires modernes. Simultanément, des molécules fluorescentes spécifiques à chaque gène viennent interagir avec l’ADN. Cette phase importante fournira une sorte de code couleur des gènes. Les gouttelettes sont ensuite guidées, une par une, à l’intérieur de sillons de taille microscopique où elles sont analysées par laser : la couleur des molécules fluorescentes révèle alors quel gène se trouve dans la gouttelette. Si cette dernière émet du rouge, par exemple, l’ADN est sain. Si elle est verte, il est tumoral. Si la gouttelette n’émet pas de fluorescence, elle ne contient pas le gène ciblé. Un simple comptage des taches colorées permet alors de connaître la concentration en ADN tumoral.
© Jean-Christophe Baret, MPI-ds
Les chercheurs ont appliqué avec succès leur méthode sur un oncogène (gène ayant le potentiel de provoquer un cancer) appelé KRAS (associé à des leucémies et à divers cancers, comme ceux du côlon, du pancréas ou du poumon). L’ADN qui portait ce gène était issu de lignées cellulaires de laboratoire. Reste maintenant à tester le nouvel outil d’analyse dans un cadre thérapeutique. Une étude clinique est d’ores et déjà prévue. Si elle réussit, les médecins disposeront d’une « arme anticancer » efficace, non seulement pour détecter la présence de tumeurs mais également pour proposer des traitements. L’agressivité du cancer, sa sensibilité aux traitements existants et son risque de récidive après un traitement local : toutes ces informations sont en partie écrites dans l’ADN tumoral. En les lisant avec la technique des
Les chercheurs ont appliqué avec succès leur méthode sur un oncogène (gène ayant le potentiel de provoquer un cancer) appelé KRAS (associé à des leucémies et à divers cancers, comme ceux du côlon, du pancréas ou du poumon). L’ADN qui portait ce gène était issu de lignées cellulaires de laboratoire. Reste maintenant à tester le nouvel outil d’analyse dans un cadre thérapeutique. Une étude clinique est d’ores et déjà prévue. Si elle réussit, les médecins disposeront d’une « arme anticancer » efficace, non seulement pour détecter la présence de tumeurs mais également pour proposer des traitements. L’agressivité du cancer, sa sensibilité aux traitements existants et son risque de récidive après un traitement local : toutes ces informations sont en partie écrites dans l’ADN tumoral. En les lisant avec la technique des microgouttelettes, l’oncologue pourrait bénéficier d’un outil d’aide au diagnostic efficace, pour prévoir l’évolution de la maladie comme pour élaborer une stratégie thérapeutique.
Ces travaux ont notamment bénéficié du soutien de la Région Alsace, de l’Association pour la recherche sur le cancer (ARC) et de l’Institut national du cancer (INCa).