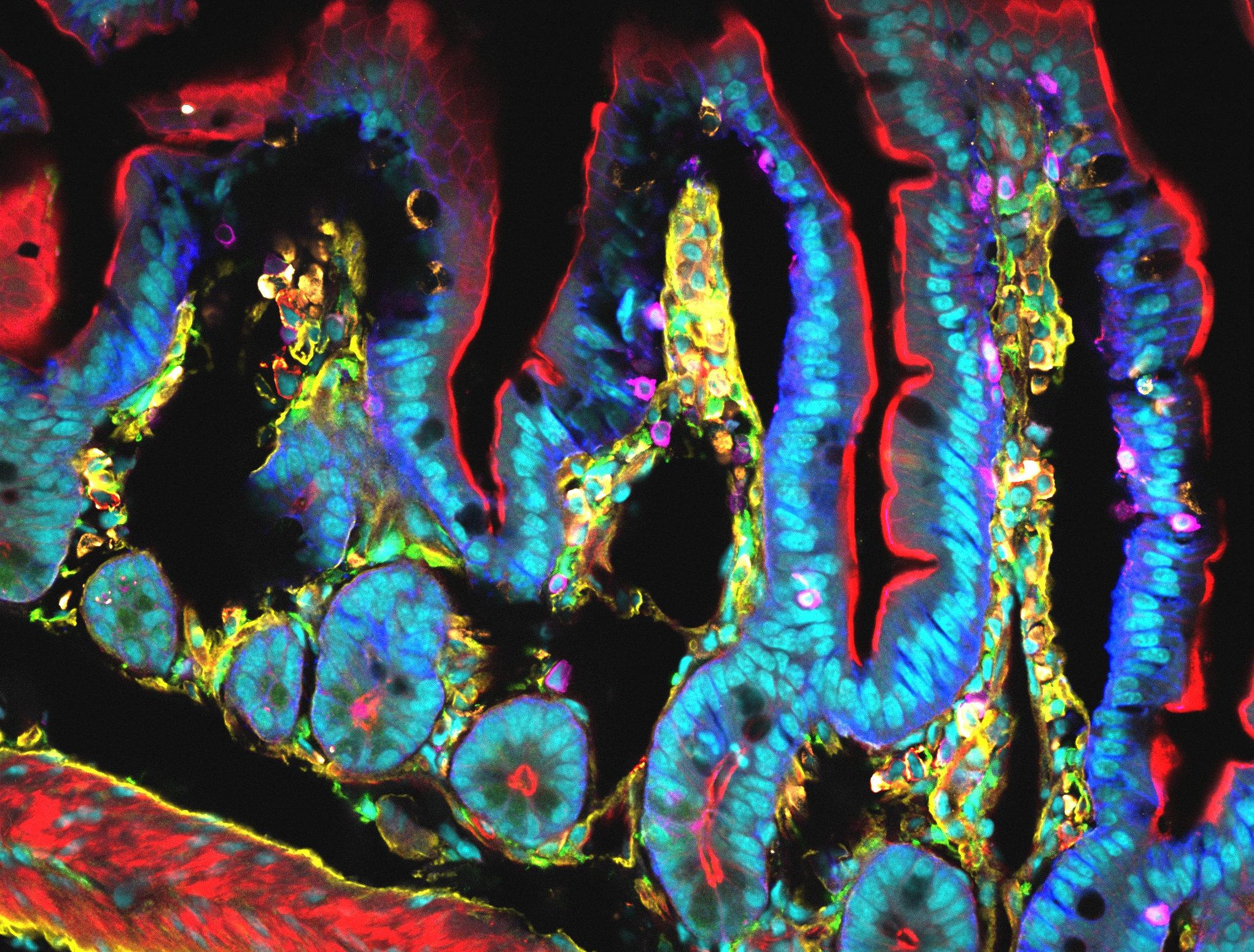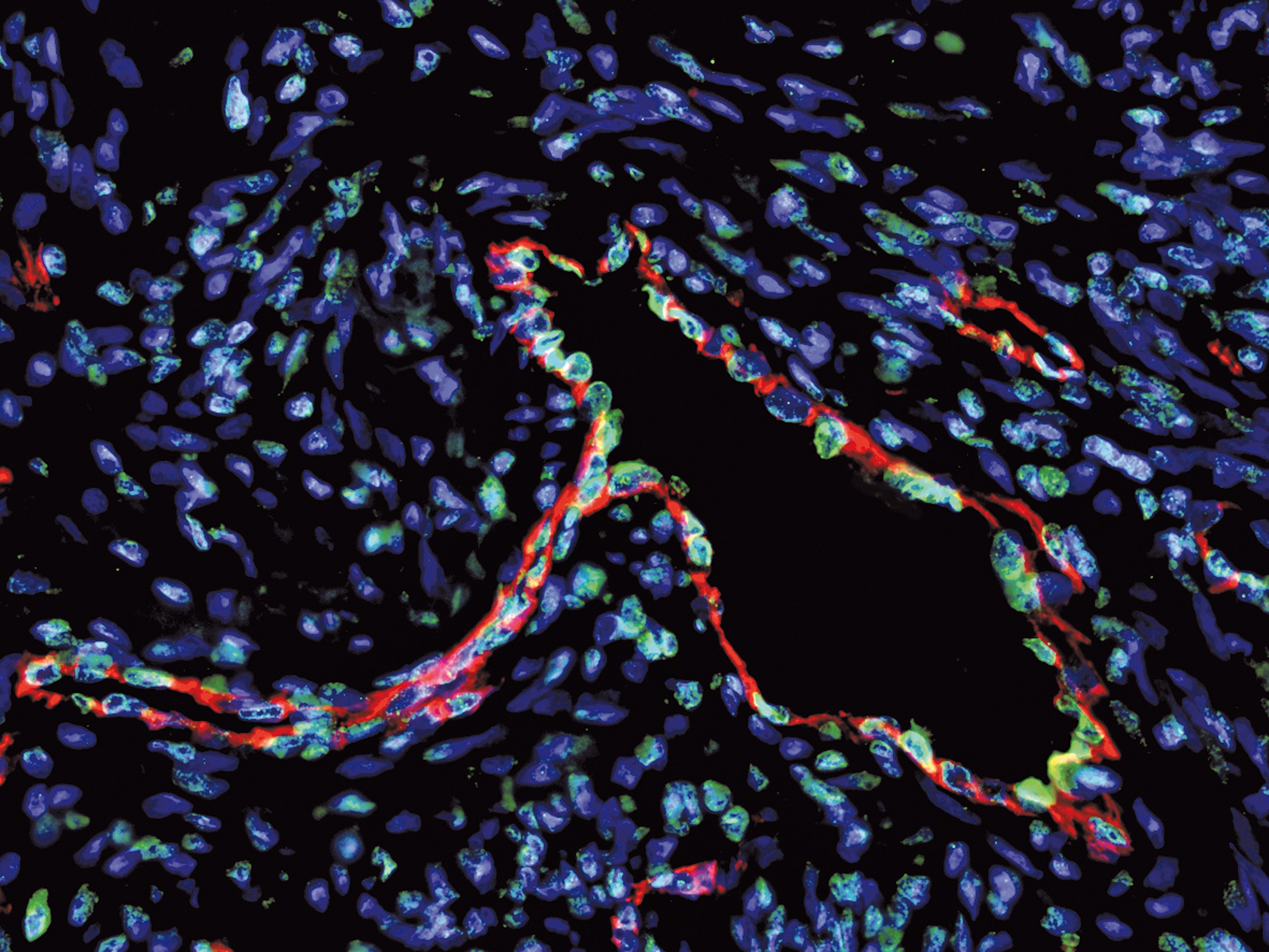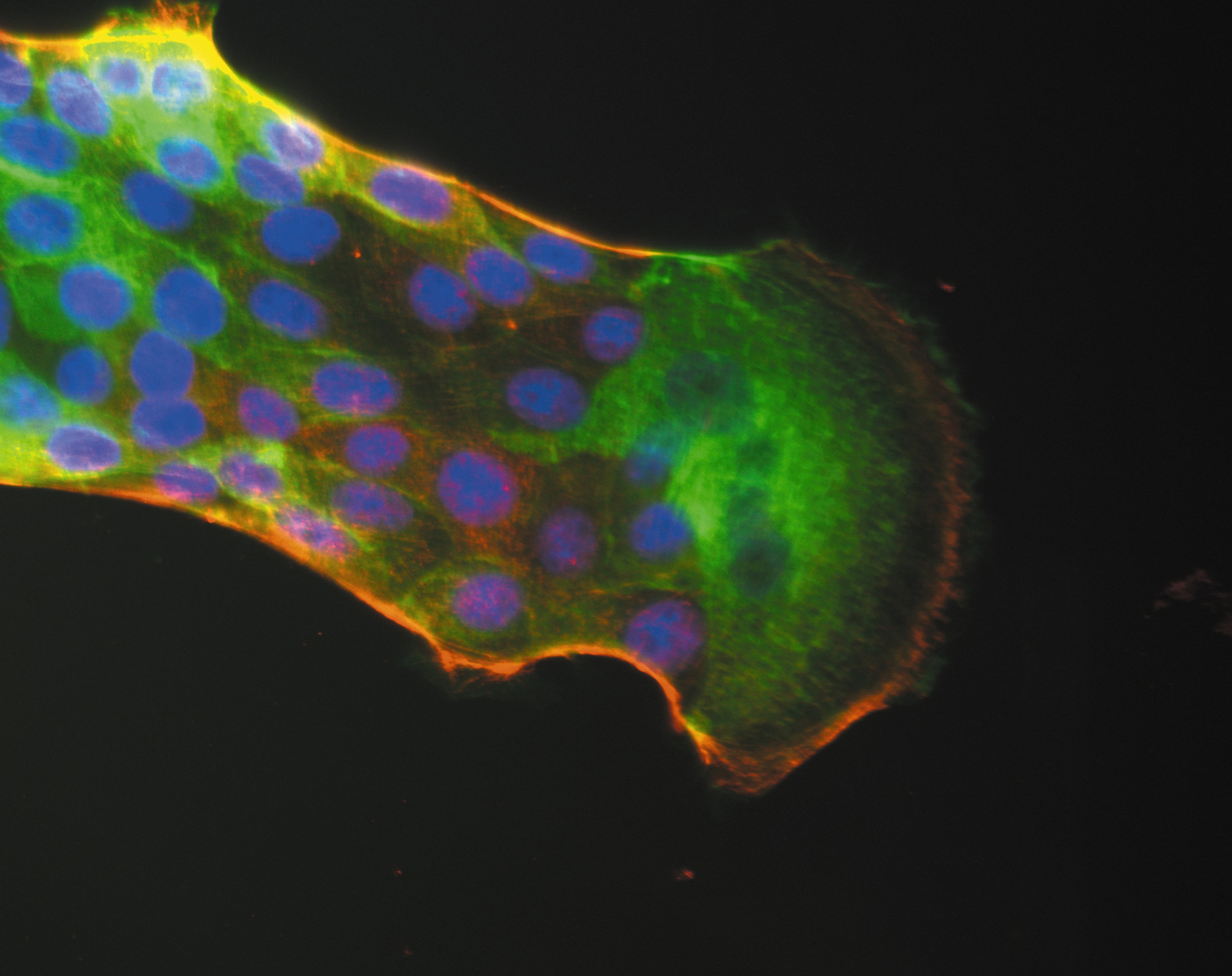
Illustration: Flore Avram/Inserm
Monalizumab ouvre de nouvelles perspectives dans le traitement des cancers par immunothérapie. Une équipe internationale de chercheurs dirigée par Eric Vivier et associant l’Inserm, le CNRS et Aix Marseille Université (au sein du Centre d’Immunologie de Marseille-Luminy), les sociétés Innate Pharma et MedImmune, en collaboration avec l’Assistance publique des Hôpitaux de Marseille, l’Institut Curie, le centre Léon Bérard, Abramson Cancer Center révèle le potentiel de ce nouvel anticorps médicamenteux (de la famille des inhibiteurs de points de contrôle immunitaire) qui, non seulement restaure l’activité anti-cancéreuse des deux principaux lymphocytes tueurs de tumeurs mais augmente aussi l’efficacité de traitements déjà existants. Chez la souris comme chez l’Homme, cet anticorps utilisé en combinaison avec une immunothérapie déjà existante, a permis de stopper l’évolution de la maladie et d’augmenter le taux de survie dans plusieurs types de cancers. Ces travaux sont publiés dans Cell.
L’immunothérapie a changé la donne dans plusieurs cancers de mauvais pronostic : mélanome métastatique, cancer avancé du rein, de la vessie, lymphome de Hodgkin, cancers de la tête et du cou, du poumon non à petites cellules… Ces progrès sont le fruit d’une première génération d’anticorps d’immunothérapie, les inhibiteurs de points de contrôle immunitaire, qui sont capables de régénérer les défenses immunitaires de l’organisme pour détruire les tumeurs. Pour cela, ils agissent sur des points de contrôle stratégiques, sorte de « freins moléculaires » que les lymphocytes T expriment à leur surface en temps normal pour éviter une suractivité du système immunitaire. Dans le cas du développement d’un cancer, la tumeur détourne l’usage normal de ces freins à son avantage, déclenchant l’arrêt total du fonctionnement des lymphocytes T : le système immunitaire n’est alors plus capable de détruire les cellules cancéreuses qui prolifèrent. De manière assez schématique, en empêchant la tumeur d’agir sur ces points de contrôle, l’immunothérapie rétablit le fonctionnement naturel des lymphocytes T qui vont alors retrouver leur rôle de destructeurs de tumeur.
Si les bénéfices cliniques de ces traitements sont spectaculaires, cette 1ère génération d’immunothérapie ne fonctionne que chez 20% des patients sans que l’on sache pourquoi. Chercheurs, cliniciens et industriels travaillent désormais main dans la main pour faire en sorte de surmonter les résistances à cette première génération d’inhibiteurs de points de contrôle. La stratégie vise à mobiliser simultanément d’autres points de contrôle de la réponse immunitaire et d’autres lymphocytes tueurs mais aussi à combiner les immunothérapies, entre elles ou avec d’autres traitements standards (chimiothérapie, radiothérapie et thérapies ciblées).
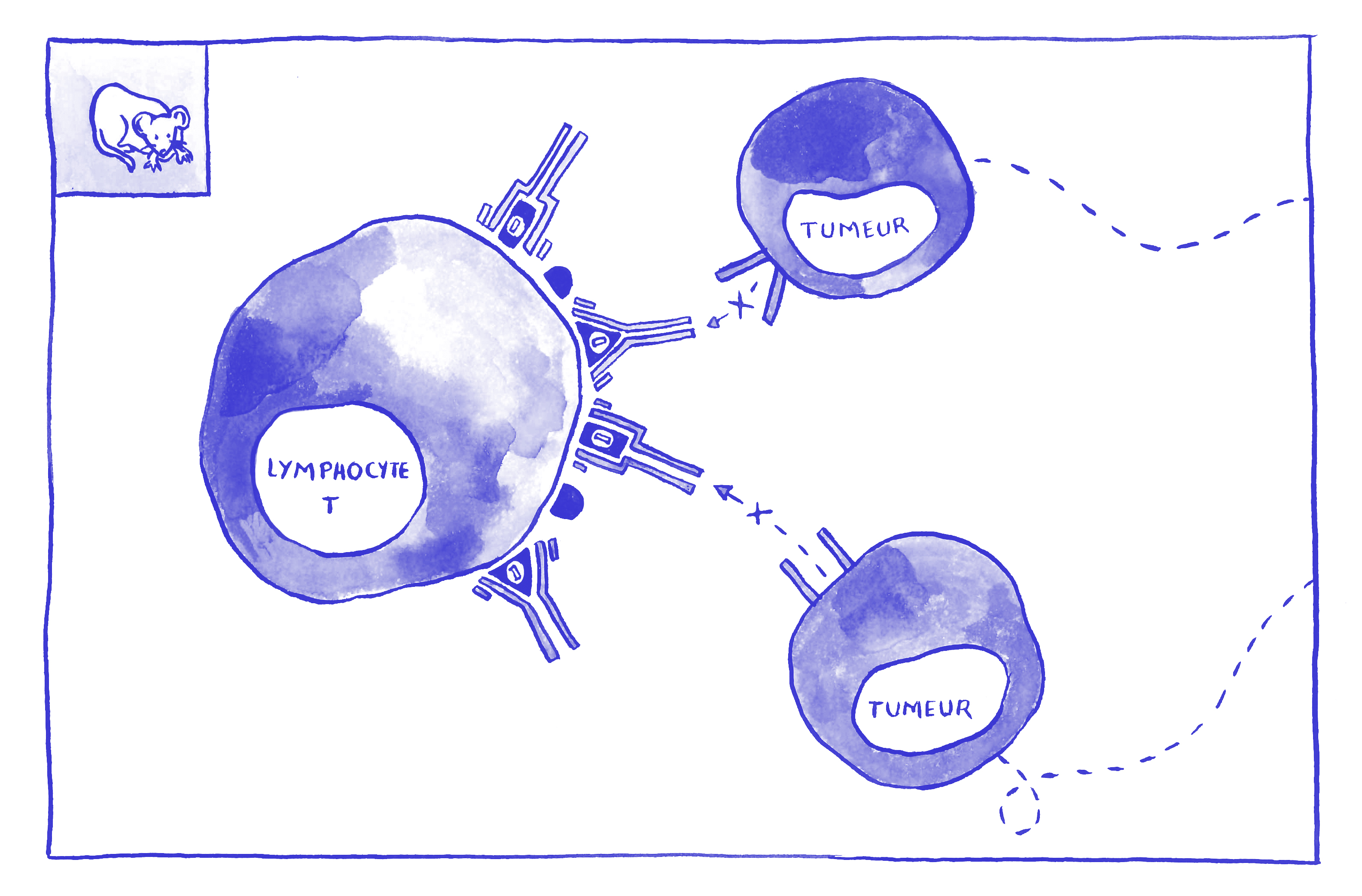
Dans ce nouveau travail, les chercheurs ont démontré le potentiel prometteur d’un nouvel anticorps : le monalizumab. L’anticorps monalizumab est capable de neutraliser directement un point de contrôle très important exprimé conjointement à la surface des cellules NK de l’immunité innée et des lymphocytes T de l’immunité adaptative : NKG2A. En bloquant ce seul point de contrôle, monalizumab restaure ainsi simultanément l’action des deux immunités.
Chez la souris, les scientifiques ont alors démontré qu’utilisé en combinaison avec une immunothérapie de 1ère génération, monalizumab améliore de manière intéressante les résultats des traitements. En effet, ce dernier potentialise l’action de l’anticorps durvalumab qui cible un mécanisme d’inhibition complémentaire de celui de NKG2A : la voie PD1/PDL1. Le taux de survie observé est ainsi augmenté : 60% de survie quand le monalizumab est utilisé en combinaison avec durvalumab contre 40% lorsque durvalumab est utilisé seul.
Chez l’Homme, dans le cadre d’un essai clinique de phase 2, monalizumab stimule l’un des mécanismes d’action du cetuximab, le traitement de référence des patients atteints d’un cancer de la tête et du cou. L’analyse des premières données de l’essai confirment les bénéfices de cette combinaison : l’évolution du cancer est stoppée chez 25 % des patients traités alors que les données d’autres essais rapportent 13 % lorsque cetuximab est utilisé seul. «En actionnant simultanément les mécanismes d’inhibition et d’activation des cellules NK nous sommes parvenus à augmenter significativement l’efficacité du meilleur standard de traitement disponible sans générer de nouveaux effets secondaires» se félicite Eric Vivier. Pour les chercheurs, il s’agit de l’identification du premier inhibiteur de points de contrôle immunitaire à large spectre qui est capable non seulement d’avoir sa propre action sur les cellules cancéreuses mais qui potentialise également l’action d’autres traitements.